
| A. | 等于2.3% | B. | 等于4% | C. | 大于2.3%小于4% | D. | 大于4% |
分析 根据钠与水反应生成氢氧化钠和氢气的方程式算出反应后溶质氢氧化钠的质量,再算出氢气质量,再计算出溶液质量,根据计算公式再算出所得溶液的质量分数.
解答 解:设2.3克金属钠与水反应生成氢氧化钠的质量为X,生成氢气质量为Y,
2Na+2H2O═2NaOH+H2↑
46 80 2
2.3g x y
$\frac{46}{2.3g}=\frac{80}{x}=\frac{2}{y}$
解得x=4g;y=0.1g,
反应后所得溶液的质量分数:$\frac{4g}{2.3g+100g-0.1g}$×100%≈3.91%.
答案:C
点评 通过回答本题可以知道有的物质放入水中溶质已经变了,要根据方程式算出溶质质量再进行计算,考查学生的计算能力,较简单.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验 编号 | 温度 | 盐酸 浓度 | 铝片消失的时间/s |
| ① | 20℃ | 5% | 60 |
| ② | 20℃ | 10% | 42 |
| ③ | 40℃ | 10% | 30 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 大理石碎屑生成的CO2质量/克 | 0 | 1.45 | 1.75 | 1.98 | 2.18 | 2.30 | 2.36 | 2.40 | 2.40 | 2.40 |
| 块状大理石生成的CO2质量/克 | 0 | 0.45 | 0.80 | 1.10 | 1.36 | 1.60 | 1.81 | 1.98 | 2.11 | 2.20 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硬水 | B. | 自来水 | C. | 蒸馏水 | D. | 矿泉水 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
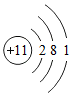 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该原子属于非金属元素的原子 | B. | 该原子形成离子后电子层数不变 | ||
| C. | 该原子的核外电子数为1 | D. | 该原子在化学反应中易失去电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图(甲)是A、B、C 种固体物质的溶解度曲线,回答下列问题:
如图(甲)是A、B、C 种固体物质的溶解度曲线,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究浓度对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com