
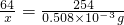
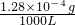 =0.128mg/m3<0.15mg/m3,符合国家标准;
=0.128mg/m3<0.15mg/m3,符合国家标准;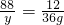
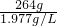 =133.5L
=133.5L 

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:初中化学 来源:同步题 题型:填空题
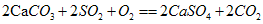 ,实验证明石灰浆[Ca(OH)2]在空气中也可吸收SO2生成硫酸钙和其他物质,写出该反应的化学方程式:________________________________。
,实验证明石灰浆[Ca(OH)2]在空气中也可吸收SO2生成硫酸钙和其他物质,写出该反应的化学方程式:________________________________。查看答案和解析>>
科目:初中化学 来源:2003年第十三届“天原杯”全国初中学生化学素质和实验能力竞赛(辽宁赛区)初赛试卷(解析版) 题型:填空题
查看答案和解析>>
科目:初中化学 来源:《7.3 使用燃料对环境的影响》2010年同步练习(1)(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com