
【题目】盐酸是实验室常用的重要试剂,请回答下列问题:
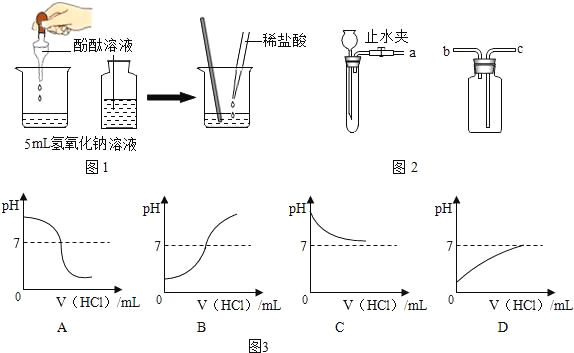
(1)为探究盐酸与氢氧化钠溶液的反应,设计下列实验方案(如图1):向5mL稀氢氧化钠溶液中滴加3滴酚酞溶液,然后逐滴加入稀盐酸,并用玻璃棒不断搅拌.
①实验过程中观察到的现象是_____.
②向稀氢氧化钠溶液滴加稀盐酸至过量,溶液pH变化的曲线正确的是(如图3)_____(填写字母标号).
(2)实验室可以利用稀盐酸等药品,通过连接图2装置制取二氧化碳、氢气.
①制取二氧化碳气体装置的连接顺序是_____(填写字母,下同),制取氢气装置的连接顺序是_____.
②块状固体加入试管中的方法是_____.
③检查发生装置气密性的方法是_____.
【答案】溶液先变红色,加入稀盐酸后溶液红色逐渐褪去 A a→c a→b 先将试管横放,用镊子夹取块状固体放在试管口,再慢慢竖立试管,使块状固体缓缓滑到试管底部 将橡胶管用止水夹夹住,然后通过长颈漏斗向试管内注水形成液面差,静置一段时间,若液面差不发生变化,说明装置的气密性良好
【解析】
(1)①氢氧化钠溶液呈碱性,能使酚酞试液变红,加入盐酸,使用玻璃棒搅拌,盐酸能与氢氧化钠反应生成氯化钠和水,氯化钠的水溶液呈中性,不能使酚酞试液变色,继续加入盐酸,溶液呈酸性,酚酞呈无色。实验过程中观察到的现象是溶液先变红色,加入稀盐酸后溶液红色逐渐褪去;
②氢氧化钠的溶液显碱性,pH值>7;随着稀盐酸的加入,溶液的pH逐渐减小,反应结束时,pH值=7;稀盐酸继续滴加,溶液显酸性,溶液的pH值<7,故选A;
(2)①由于二氧化碳的密度比空气大,因此进气管是长管,而氢气的密度比空气小,因此进气管是短管。故答案为:a→c;a→b;
②向试管中加入块状固体药品时,为了防止打破试管底,要把试管横放,然后用镊子取用块状固体放在试管口,再慢慢竖起试管,让固体缓缓滑到试管底部;
③将橡胶管用止水夹夹住,然后通过长颈漏斗向试管内注水形成液面差,静置一段时间,若液面差不发生变化,说明装置的气密性良好,若继续下降,则说明此装置气密性不好。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:初中化学 来源: 题型:
【题目】有氯酸钾和二氧化锰的混合物共26.5g,加热使之反应,待反应至不再有气体生成后,将试管冷却、称量,得到剩余固体16.9g。求:
(1)制取氧气的质量?
(2)原混合物中氯酸钾的质量?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)用化学用语填空
①2个氧原子:_____;
②钙离子:_____;
③+2价的镁元素:_____;
④1个氮分子:_____;
⑤五氧化二氮_____.
(2)写出下列化学反应的符号表达式:
铁丝在氧气中燃烧_____
过氧化氢和二氧化锰制取氧气_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】侯氏制碱法生产的碳酸钠中常含有少量的氯化钠。某学习小组对其组成展开探究。取碳酸钠和氯化钠的混合物样品24g,加入100g水使其完全溶解,再加入96g过量的氯化钙溶液,反应过程中生成沉淀的质量与氯化钙溶液的质量关系如图所示:
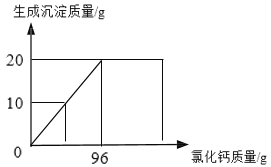
(1)完全反应时,得到的沉淀质量是_____g。
(2)计算样品中Na2CO3的质量分数_____(写出计算过程,结果保留一位小数)。
(3)通过已知数据,可以求出的量有_____(写字母)。
A反应后溶液的总质量
B参加反应的氯化钙质量
C氯化钙溶液中溶质的质量分数
D恰好完全反应时,溶液中氯化钠的溶质质量分数
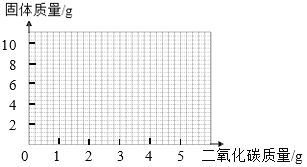
(4)取混合物样品12g,加入足量的稀盐酸,将生成的二氧化碳通入盛有8g炽热碳粉的密闭容器中充分反应,在下图中画出二氧化碳的质量与容器中固体质量变化的关系图。_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(8分)盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。
(1)增大压强,HCl由气态变为液态,从微观的角度分析该变化过程中改变的是_______________ 。
(2)在盐酸中加入过量的铁粉充分反应。
①可以看到的现象是_____________________________。
②下图表示该反应前后溶液中存在的主要离子,请写出每种图形代表的离子(填离子符号):
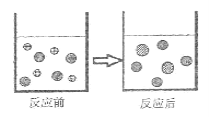
![]()
③下列金属中能与盐酸发生类似反应的是 (填选项)。
A.Cu B.Mg C.Al D.Ag
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钙被称为人体中的“钢筋混凝土”。
(人体中的钙)
(1)人体缺钙不会导致_____(填字母,下同)。
A 侏儒症 B 佝偻病 C 骨质疏松
(2)人体中钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙[Ca10(PO4)6(OH)2]形式存在,其中磷酸根(PO4)化合价为_____。
(单质钙)
提出问题:钙的化合物很多,为什么我们很少提起单质钙呢?
思考猜想:钙的化学性质活泼。
实验验证一:
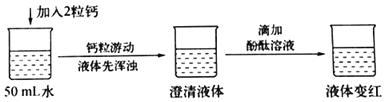
查阅资料:在一个化学反应中,有元素化合价升高,同时就有元素化合价降低。
(3)实验结论:①写出钙与水反应的化学方程式_____。
②该反应_____(填“吸收”或“放出”)热量。
(干燥剂中的钙)
提出问题:一包生石灰干燥剂,使用一段时间后可能有哪些固体?
猜想假设:固体中含有氧化钙、氢氧化钙、碳酸钙。
实验验证二:
(4)取固体样品加入水中,若温度明显升高,则含有_____;滴加酚酞后液体变红;继续加足量稀盐酸,如观察到_____,则固体中含有碳酸钙。
(5)小明认为无法判断是否含有氢氧化钙,理由是_____。
(6)为了进一步确定固体样品的成分及质量,实验小组利用如图所示的装置(夹持仪器省略)进行实验。
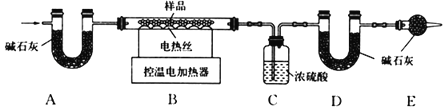
查阅资料:氢氧化钙加热至580℃、碳酸钙加热至825℃分别分解生成两种氧化物。
①实验前首先要_____,再装入药品。
②装置E的作用是_____。
③控温电加热器使装置B中反应完全,再通一段时间空气,测得反应前后装置C、D分别增重9.0g和11.0g,将装置B中反应后剩余的固体氧化物加入足量水中溶解,蒸发所得固体(不含水)增重18.0g,求原固体样品中各成分的质量。(请写出计算过程)_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值。下列叙述中正确的是( )
A. 分子总数为NA 的NO2和CO2混合气体中含有的氧原子数为4NA
B. 常温常压下,92gNO2和N2O4混合气体中含有的原子数为6NA
C. 1mol SO3中含有的分子数目为4NA
D. 含有3.01×1023个原子的氮气中,N2的分子数为0.5NA
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)KNO3和NaCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |||||||||
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | |||||||||
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图所示:
图中能表示KNO3溶解度曲线的是 (填“A”或“B”)
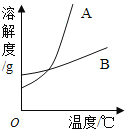
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解 度,则温度的范围是 ;
(3)某兴趣小组做了一下实验:
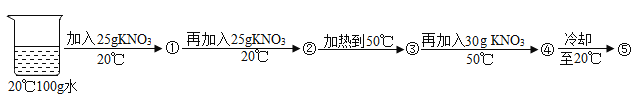
上述实验过程中得到的溶液一定属于不饱和溶液的是 (填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体 g;
(4)硝酸钾中含有少量氯化钠时,可通过 (填“蒸发结晶”或“降温结晶”)的方法提纯。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图装置,回答下列有关问题:
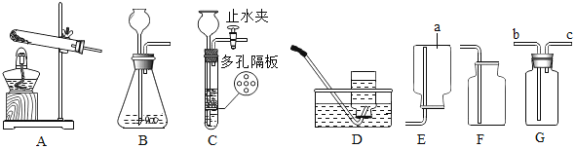
(1)装置图中仪器a的名称为____________。
(2)用加热高锰酸钾制取氧气,装置A还需做的一点改动是 __________________;化学方程式为__________________。
(3)用过氧化氢制氧气,选用的装置组合是________________,化学反应方程式为_________________;
(4)若用G装置采用排空法收集氢气,氢气应从_____________进(选“b”或“c”) ;
若用装满水的G装置收集氧气,则氧气从_____________进(选“b”或“c”)。
(5)制取二氧化碳最好选用的发生装置是C,该装置与另一个可选用的装置相比,其主要优点是___________________,反应方程式为__________________;
(6)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰。正确操作的先后顺序是____________(填写选项序号)。a.烘干 b.溶解 c.过滤 d.洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com