
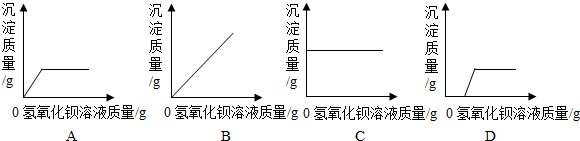
分析 根据硫酸钠与氢氧化钡反应生成了硫酸钡沉淀和氢氧化钠分析回答有关的问题.
解答 解:向一盛有硫酸钠的烧杯中逐滴加入氢氧化钡溶液生成了硫酸钡沉淀和氢氧化钠,在这过程中发生的反应的化学方程式为:Ba(OH)2+Na2SO4=2NaOH+BaSO4↓,随着氢氧化钡溶液的滴入,烧杯溶液中减少的离子是硫酸根离子,增加的离子是氢氧根离子.从开始滴入氢氧化钡溶液直至过量,生成沉淀的质量逐渐增加,当硫酸钠完全反应时不再增加,所以生成沉淀的质量与加入氢氧化钡溶液的质量关系正确的图象是A.
故答为:Ba(OH)2+Na2SO4=2NaOH+BaSO4↓,硫酸根离子,氢氧根离子,A.
点评 本题的难度不大,了解硫酸钠与氢氧化钡反应的实质是解答本题的基础.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
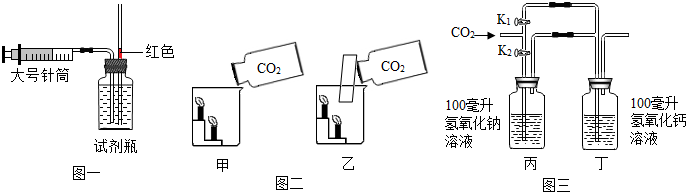
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
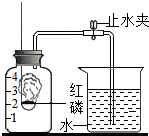 某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 如图是某同学制作的简易净水器,请回答下列问题:
如图是某同学制作的简易净水器,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只有二氧化锰能做催化剂 | |
| B. | 催化剂加快反应速率 | |
| C. | 催化剂不能减缓反应速率 | |
| D. | 反应前后催化剂的化学性质不会改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 测定结果 | 白色固体成分 |
| 用pH试纸测定反应后溶液的酸碱度,操作方法是 | pH>7 | |
| CaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com