
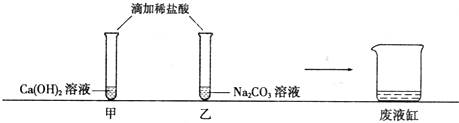
分析 【观察与讨论1】根据向氢氧化钙溶液中应先滴几滴酚酞试液,则溶液为红色,如果红色消失,则说明反应进行分析;
【观察与讨论2】根据废液缸中先有气泡产生,然后又出现了白色沉淀,能够产生气体的是碳酸根和酸,能够生成沉淀的是碳酸根和钙离子进行分析;
【猜想与假设】根据碳酸钠和氯化钙反应时,可能一种物质过量,也可能两种物质恰好完全反应进行分析;
【反思与评价】根据废液滴加碳酸钠溶液,“无明显现象,得出结论:甲猜想不成立,则乙猜想成立”,如果只有氯化钠也无现象进行分析.
解答 解:【观察与讨论1】酚酞溶液遇碱性溶液会变红;而在中性或酸性溶液中无色,所以可以用酚酞溶液来判断碱是否被中和;
【观察与讨论2】废液缸中先有气泡产生,然后又出现了白色沉淀,结合图中所给的甲和乙的药品可以知道,甲中盐酸和氢氧化钙溶液生成氯化钙和水,乙中盐酸和碳酸钠生成氯化钠和水和二氧化碳,而一开始没有沉淀但是有气体产生,说明甲中所加入的盐酸是过量的,而乙中的碳酸钠没有被完全消耗掉,故可以判断甲中含有的溶质为氯化钙和盐酸,而废液中含有的溶质为碳酸钠和氯化钠;
【猜想与假设】碳酸钠和氯化钙反应时,可能一种物质过量,也可能两种物质恰好完全反应,所以我的猜想是废液中含有氯化钠;
【反思与评价】废液滴加碳酸钠溶液,“无明显现象,得出结论:甲猜想不成立,则乙猜想成立”,如果只有氯化钠也无现象,所以甲同学结论不正确,甲实验只能说明废液中无CaCl2,不能确定溶液中是否含有Na2CO3.
故答案为:【观察与讨论1】溶液由红色变无色;
【观察与讨论2】CaCl2、HCl,NaCl、Na2CO3;
【猜想与假设】NaCl;
【反思与评价】甲同学结论不正确,甲实验只能说明废液中无CaCl2,不能确定溶液中是否含有Na2CO3.
点评 本题主要考查化学实验方案的设计与评价,学会运用猜想与事实验证的方法和技巧处理实验问题.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 12 | 1.2 | 2 | 5 |
| 反应后质量/g | 2 | 1.2 | x | 12 |
| A. | 甲是反应物 | B. | 测得反应后丙的质量为3g | ||
| C. | 乙一定是催化剂 | D. | 该反应是分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 序号 | 过氧化氢溶液浓度∕% | 过氧化氢溶液体积∕m L | 温度∕℃ | 二氧化锰的用量∕g | 收集氧气的体积∕m L | 反应所需的时间∕s |
| Ⅰ | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| Ⅱ | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| Ⅲ | 30 | 5 | 35 | 2 | 49.21 | |
| Ⅳ | 30 | 5 | 55 | 2 | 10.76 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 人类生活离不开金属.
人类生活离不开金属.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com