
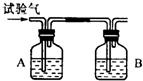
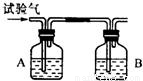
 为了确定CH4、H2和CO(简称试验气)三种可燃性气体,可分别让他们在氧气中燃烧,把燃烧后生成的气体依次通过A、B两个洗气瓶.回答下列问题:
为了确定CH4、H2和CO(简称试验气)三种可燃性气体,可分别让他们在氧气中燃烧,把燃烧后生成的气体依次通过A、B两个洗气瓶.回答下列问题: 2H2O.故答案为:氢气、2H2+O2
2H2O.故答案为:氢气、2H2+O2 2H2O;
2H2O; C02+2H2O
C02+2H2O =
=


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:初中化学 来源: 题型:
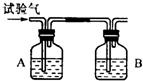 为了确定CH4、H2和CO(简称试验气)三种可燃性气体,可分别让他们在氧气中燃烧,把燃烧后生成的气体依次通过A、B两个洗气瓶.回答下列问题:
为了确定CH4、H2和CO(简称试验气)三种可燃性气体,可分别让他们在氧气中燃烧,把燃烧后生成的气体依次通过A、B两个洗气瓶.回答下列问题:查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:初中化学 来源:1997年第七届“天原杯”全国初中学生化学素质和实验能力竞赛复赛试卷(解析版) 题型:填空题
查看答案和解析>>
科目:初中化学 来源:《第4章 燃烧与燃料》2011年单元测试卷(1)(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com