解:研究一、
(1)镁的化学性质较活泼易在其表面形成氧化镁保护膜,打磨后有利于反应的进行.
(2)放热;Mg+2HCl=MgCl
2+H
2↑;
研究二、
发现问题:依据酸碱性溶液pH的大小进行分析判断;
(1)pH小于7的溶液呈酸性,所以该溶液显酸性;
(2)pH大于7的溶液呈碱性,所以该溶液显碱性;
实验思考:氯化镁溶液的酸碱性,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,说明生成了碱性物质,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧说明生成了可燃性气体,根据质量守恒定律中反应前后元素的种类不变,可知该反应的产物是氢氧化镁和氢气,其方程式为:Mg+2H
2O

Mg(OH)
2+H
2↑;
拓展延伸:(1)氯化钠溶液显中性,氯化镁溶液显弱酸性,钾的活动性比钠要强,所以氯化钾的溶液呈中性;
(2)依据钠与水反应不需要加热,而镁与水反应需要加热可知:金属与水的反应与金属活动性顺序有关.
故答案为:研究一、
(1)去除表面的氧化镁等杂质
(2)放热反应,镁与盐酸反应会生成氢气及氯化镁,其方程式为:Mg+2HCl=MgCl
2+H
2↑;反应放出热量,温度升高,反应速率加快
研究二、
发现问题:(1)酸;(2)碱;
实验思考:氯化镁;Mg+2H
2O

Mg(OH)
2+H
2↑;
拓展延伸:(1)中;(2)有关;
分析:研究一、
(1)依据镁的化学性质较活泼易形成氧化镁保护膜进行分析;
(2)依据反应时温度的变化分析反应时能量的问题,依据镁与盐酸反应会生成氢气及氯化镁书写方程式;
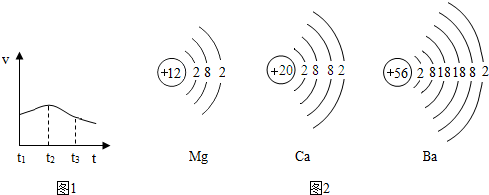
(3)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,推测t
1~t
2时间内反应速率逐渐加快的主要原因;
研究二、
发现问题:依据酸碱性溶液pH的大小进行分析判断;
实验思考:根据甲乙同学的不同猜想分析两人必做的实验操作,以据反应的现象结合质量守恒定律的有关应用对化学方程式进行书写即可;
拓展延伸:(1)依据题目中有关的信息对相关物质的溶液酸碱性进行判断即可;
(2)根据活泼金属与水反应的条件分析即可;
点评:此题是一道实验探究题,解题的关键是分析实验的过程,并结合题中所给的信息结合所学相关知识对问题进行探讨与分析.化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.

 以下是甲、乙两同学对有关镁与盐酸反应的系列研究
以下是甲、乙两同学对有关镁与盐酸反应的系列研究 Mg(OH)2+H2↑;
Mg(OH)2+H2↑; Mg(OH)2+H2↑;
Mg(OH)2+H2↑;

 以下是甲、乙两同学对有关镁与盐酸反应的系列研究
以下是甲、乙两同学对有关镁与盐酸反应的系列研究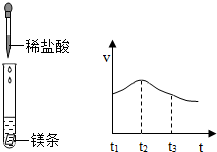
 以下是甲、乙两同学对有关镁与盐酸反应的系列研究
以下是甲、乙两同学对有关镁与盐酸反应的系列研究