
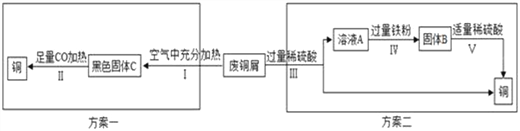
【题目】铜是生活中常见的金属.让我们化学兴趣小组一起探究:久置的铜制品表面能生成 Cu2(OH)2CO3.甲组同学以锈蚀严重的废铜屑为原料(假设不含其他杂质)制取纯铜.如图是兴趣小组设计的两种回收铜的实验方案:
【查阅资料】Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑
【分析评价】
(1)黑色固体C是_________
(2)步骤Ⅱ的化学反应方程式_________________
(3)步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是_________,需要用到的玻璃仪器有烧杯、玻璃棒、_________,玻璃棒的作用是__________
(4)步骤Ⅴ过程发生反应的化学方程式为_____________________.
(5)同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一_____(填“>”或“=”或“<”)方案二。两种方案中,方案二优越于方案一,理由是______(答一点)
【答案】 CuO ![]()
![]()
![]() 过滤 漏斗 引流
过滤 漏斗 引流 ![]() = 操作简单(合理即可)
= 操作简单(合理即可)
【解析】(1)铜在空气中加热生成氧化铜,所以黑色固体为氧化铜,化学式为CuO ;(2)步骤Ⅱ是一氧化碳和氧化铜在加热的条件下反应生成铜和二氧化碳,化学反应方程式为: ![]()
![]()
![]() ;(3)步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是过滤,通过过滤把液体和固体分离;需要用到的玻璃仪器有烧杯、玻璃棒、漏斗,玻璃棒在过滤中的作用是引流;(4)步骤Ⅴ过程中,铁和稀硫酸反应生成硫酸亚铁和氢气,发生反应的化学方程式为:
;(3)步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是过滤,通过过滤把液体和固体分离;需要用到的玻璃仪器有烧杯、玻璃棒、漏斗,玻璃棒在过滤中的作用是引流;(4)步骤Ⅴ过程中,铁和稀硫酸反应生成硫酸亚铁和氢气,发生反应的化学方程式为: ![]() ;(5)上述两种方案中,铜元素既没有增加,也没有减少,同一份废铜屑分别通过上述两种方案最终得到的铜的质量相等;以上两种方案中,方案二优越于方案一,理由是方案二操作简单,节约能源,更安全、环保。
;(5)上述两种方案中,铜元素既没有增加,也没有减少,同一份废铜屑分别通过上述两种方案最终得到的铜的质量相等;以上两种方案中,方案二优越于方案一,理由是方案二操作简单,节约能源,更安全、环保。


科目:初中化学 来源: 题型:
【题目】氧化锌为白色粉末,无臭、无味,广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,为了变废为宝,综合应用资源,经常从锌冶炼、锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来制取氧化锌,其流程如下图所示:
信息:1、3FeO+10HNO3=3Fe(NO3)3+NO+5H2O,NO有毒,能与氧气和水反应生成硝酸。 2、在“除杂Ⅰ”步骤中,只有铁离子能形成氢氧化铁沉淀。
回答下列问题
(1)在酸浸过程中,经常要保持酸过量,理由是;通入空气的目的是:①起搅拌作用,使反应充分,②。通入空气反应的化学方程式为。
(2)在“除杂Ⅰ”步骤中,加入一种金属氧化物与过量的硝酸反应,使溶液pH升高为4左右,请结合本厂实际,可加入的物质是
A.ZnO
B.FeO
C.Fe2O3
D.CuO
(3)为了使产品更加纯净,在“除杂Ⅱ”步骤中,滤渣的成分是。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],还生成一种能使澄清石灰水变浑浊的气体氧化物。请写出碳化合成步骤的化学方程式。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】善于梳理化学知识,能使你头脑更聪明。以下对应完全正确的一组是( )
A | 物质的性质与用途 | B | 安全常识 |
N2性质稳定—可作灯泡填充气 石墨很软—可作电极 | 假酒中毒—由甲醛引起 煤矿爆炸—由瓦斯引起 | ||
C | 元素与人体健康 | D | 日常生活经验 |
缺维生素C—易引起坏血病 缺钙—易骨质疏松或得佝偻病 | 食品干燥剂—常用CuO 鉴别羊毛纤维—点燃嗅闻有烧毛发味 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验中可观察到明显现象的是
A.向盐酸中滴加氢氧化钠溶液B.碳酸钠溶液中滴加澄清石灰水
C.向稀硫酸中加入酚酞溶液D.将铜丝放入硫酸铝溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com