
| A. | 向某无色溶液中滴入酚酞试液,呈红色,证明该溶液是碱溶液 | |
| B. | 向某无色溶液中滴入硝酸银溶液,产生白色沉淀,证明该溶液是盐酸 | |
| C. | 某白色固体与熟石灰混合后加热,产生可使湿润的红色石蕊试纸变蓝色的气体,证明该固体是铵盐 | |
| D. | 把燃着的木条伸入某无色气体的集气瓶中,火焰熄灭,则该气体是二氧化碳 |
分析 A、根据显碱性的不一定是碱溶液,进行分析判断.
B、根据盐酸、盐酸盐等能与硝酸银溶液反应生成氯化银白色沉淀,进行分析判断.
C、根据铵盐能与碱性物质混合产生氨气,进行分析判断.
D、根据不能支持燃烧的气体能使燃着的木条熄灭,进行分析判断.
解答 解:A、向某无色溶液中滴入酚酞试液,呈红色,该溶液不一定是碱溶液,也可能是碳酸钠等盐溶液,故选项说法错误.
B、向某无色溶液中滴入硝酸银溶液,产生白色沉淀,证明该溶液不一定是盐酸,也可能是氯化钠等盐,故选项说法错误.
C、铵盐能与碱性物质混合产生氨气,某白色固体与熟石灰混合后加热,产生可使湿润的红色石蕊试纸变蓝色的气体,证明该固体是铵盐,故选项说法正确.
D、把燃着的木条伸入某无色气体的集气瓶中,火焰熄灭,则该气体不一定是二氧化碳,也可能是氮气等,故选项说法错误.
故选:C.
点评 本题难度不是很大,化学实验方案的设计与评价是考查学生能力的主要类型,同时也是实验教与学难点,在具体解题时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断.


科目:初中化学 来源: 题型:多选题
| A. | 该反应不符合复分解反应发生的条件 | |
| B. | 该反应中四种物质都是盐 | |
| C. | 反应后可用过滤的方法分离出NaHCO3 | |
| D. | 反应后的溶液中不能继续溶解NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 元素符号不同 | B. | 原子质量不同 | ||
| C. | 原子的质子数不同 | D. | 原子的电子数不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
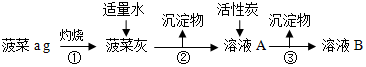
| 试管 | 加入适量检验药品 | 实验现象 |
| 甲 | 酸性高锰酸钾溶液 | 酸性高锰酸钾溶液紫色褪去 |
| 乙 | 硫氰化钾溶液 | 溶液不变血红色 |
| 丙 | 先加入稀硝酸,再加入硫氰化钾溶液 | 溶液变血红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展,以从海水中提取出来的食盐为主要原料制取纯碱.其生产过程中有下列反应:①NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl ②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑试回答下列问题:
1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展,以从海水中提取出来的食盐为主要原料制取纯碱.其生产过程中有下列反应:①NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl ②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑试回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Mg+O2$\frac{\underline{\;点燃\;}}{\;}$MgO:化合反应 | |
| B. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2:分解反应 | |
| C. | CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2:置换反应 | |
| D. | Al(OH)3+3HCl=AiCl3+3H2O:复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com