
分析 根据黄铜的成分铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应硫酸的质量,进而计算出铜的质量和铜的质量分数.
解答 解:(1)根据质量守恒定律,产生氢气的质量为:200g+40g-239.6g=0.4g;
(2)设黄铜样品中锌的质量为x,参加反应的硫酸溶液中溶质的质量为y,
Zn+H2SO4═ZnSO4+H2↑
65 98 2
x y 0.4g
$\frac{65}{x}$=$\frac{98}{y}$=$\frac{2}{0.4g}$
x=13g
y=19.6g
参加反应的硫酸溶液中溶质的质量为:19.6g;
黄铜样品中铜的质量分数为:$\frac{40g-13g}{40g}$×100%=67.5%.
故答案为:(1)0.4g;
(2)19.6g;
(3)黄铜样品中铜的质量分数为67.5%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.


科目:初中化学 来源: 题型:解答题
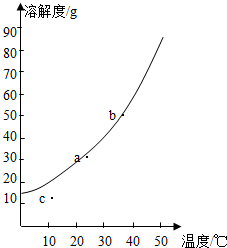

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
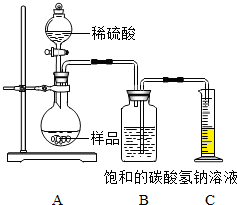 实验室中有一瓶长期使用的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行探究.
实验室中有一瓶长期使用的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行探究.| 实验操作 | 实验现象 |
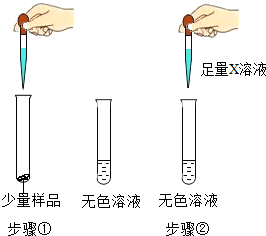 | 步骤①:样品全部溶解 步骤②:观察到现象A |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 在元素周期表中,硫元素的信息如图所示,下列从图中获得的信息不正确的是( )
在元素周期表中,硫元素的信息如图所示,下列从图中获得的信息不正确的是( )| A. | 在硫原子的核外电子排布中a=2和b=8 | |
| B. | 硫原子在化学反应中易获得2个电子生成S2- | |
| C. | 硫原子里,质子数=中子数=电子数=16 | |
| D. | 一个硫原子的相对原子质量是32.06克 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com