
【题目】某无色溶液M中可能含有硫酸钠、氯化钠、碳酸钠、氢氧化钠、氢氧化钙中的一种或几种,为确定其成分,某兴趣小组同学设计实验并进行探究。
探究活动一:小组同学进行了如下图所示实验
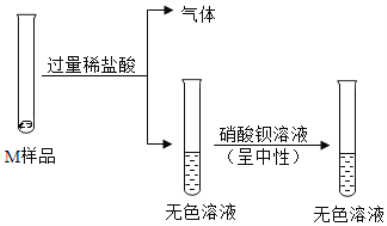
(1)反应生成气体的化学方程式是____________________________;
(2)M 中一定没有________________(填名称或化学式均可,下同);
探究活动二:为进一步确定M的成分,进行如下实验:
Ⅰ.重新取M样品,滴加酚酞;
Ⅱ.向Ⅰ所得溶液中滴加过量的试剂X,静置;
Ⅲ.向Ⅱ所得混合物中滴加过量的稀硝酸;
Ⅳ.向Ⅲ所得的溶液中滴加试剂Y,产生白色沉淀,过滤,得到滤渣和滤液。
通过探究活动二,得出结论:样品中可能存在的物质确实存在。
完成填空:
(3)试剂X是_____________(选填“氯化钡”“硝酸钡”“硝酸”或“氢氧化钡”)溶液;
(4)能确定M中含有氢氧化钠的现象是_____________________________;
(5)步骤Ⅳ所得滤液中除指示剂外,还一定含有的溶质是_____________________。
【答案】Na2CO3+2HCl═2NaCl+H2O+CO2↑ 氢氧化钙、硫酸钠 硝酸钡 向Ⅰ所得溶液中滴加过量的硝酸钡溶液后,溶液仍然是红色的 硝酸钡、硝酸钠、硝酸
【解析】
探究活动一:
(1)反应生成气体,是因为稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑。
(2)M中含有碳酸钠,则一定没有氢氧化钙,这是因为氢氧化钙和碳酸钠不能共存,加入硝酸钡得到无色溶液,说明M中一定没有硫酸钠。
探究活动二:
(3)试剂X是硝酸钡溶液,加入过量的硝酸钡时,能够除去碳酸钠,以防止对检验氢氧化钠产生影响。
(4)能确定M中含有氢氧化钠的现象是向Ⅰ所得溶液中滴加过量的硝酸钡溶液后,溶液仍然是红色的,这是因为除去碳酸钠后,如果溶液仍然是红色溶液,说明溶液显碱性,进一步说明溶液中含有氢氧化钠。
(5)Ⅲ得到的是溶液,说明溶液中不含有硫酸钠,滴加的试剂Y是硝酸银溶液,产生白色沉淀,是因为硝酸银和氯化钠反应生成了白色沉淀氯化银,说明溶液中含有氯化钠,步骤Ⅳ所得滤液中除指示剂外,还一定含有的溶质是过量的硝酸钡、反应生成的硝酸钠和加入的硝酸。


科目:初中化学 来源: 题型:
【题目】盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。
(1)打开浓盐酸的试剂瓶塞,可观察到瓶口有白雾产生,这是因为浓盐酸有_______性。
(2)稀盐酸可用于去除铁锈。将一根生锈铁钉加入稀盐酸中,开始阶段可观察到的现象是__________,反应的化学方程式为__________。除锈时稀盐酸应选用适量而不是过量的原因是___________。
(3)用稀盐酸按照如下图的方式进行中和反应实验。向烧杯中逐滴滴入稀盐酸至过量的过程中,能说明稀盐酸与氢氧化钠溶液发生了化学反应的实验现象是________。
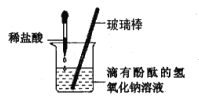
(4)在本实验中,不能证明滴加的稀盐酸已过量的操作及现象的叙述是_________(填标号)。
A.加入金属锌片,产生气泡 B.另滴加氢氧化钠溶液,搅拌后溶液颜色不变
C.加入蒸馏水,搅拌后溶液颜色不变 D.滴加紫色石蕊试液,搅拌后溶液变红
(5)下列实验中一定不可能用到盐酸的是_________(填标号)。
A.鉴别氢氧化钾和碳酸钾 B.除去氯化钠中的碳酸钠
C.实验室制取二氧化碳 D.干燥氧气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有镁、铝两种金属分别与稀盐酸充分反应,生成相同质量氢气。某同学推测的情况如下:①足量的稀盐酸与等质量的镁、铝分别发生反应;②足量的稀盐酸与质量比为4∶3的镁、铝分别发生反应;③足量的稀盐酸与质量比为8∶9的镁、铝分别发生反应;④等质量、等溶质质量分数的稀盐酸与过量的镁、铝分别发生反应,其中正确的推测是( )
A. ①② B. ①④ C. ②④ D. ③④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了消除人体碘缺乏病,我国政府规定食用盐是加碘食盐,简称碘盐。所谓碘盐就是在食盐中加入一定量的碘酸钾(KIO3)。计算(计算结果精确到0.1)
(1)KIO3的相对分子质量为__________________,
(2)碘酸钾中各元素的质量比K:I:O = __________________,
(3)42.8g碘酸钾中含碘元素的质量为______(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右图中A、B、甲、乙、丙均是初中化学常见的物质,其中甲、乙、丙属于同种类别的化合物;甲、丙和足量的A反应能生成相同的生成物。A、B均含两种元素,其混合物有挥发性,挥发出的气体能使湿润的蓝色石蕊试纸变红。丙的相对分子质量为106,被广泛应用于玻璃、纺织等工业。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在相应的转化关系,部分反应物、生成物及反应条件已略去。下列推断错误的是( )
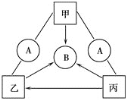
A. 甲、乙、丙均属于盐类
B. 丙和A发生的反应属于复分解反应
C. 除去乙中混有的丙可通过溶解、过滤、洗涤、干燥来达到目的
D. 可用无色酚酞溶液一次性鉴别甲、丙、A的溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知氧化铜也可以催化过氧化氢的分解,现向一定量的过氧化氢的水溶液中加入适量的氧化铜粉末,充分反应(忽略水的挥发).下列图象不正确的是
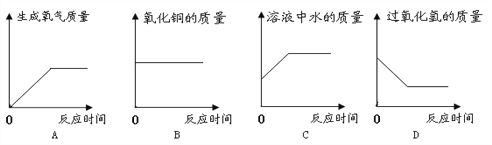
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在宏观、微观和符号之间建立联系是化学学科的特点,汽车尾气排放的有毒气体可在“催化转化器”中转化为无污染的气体。如图为微观反应示意图,请回答:
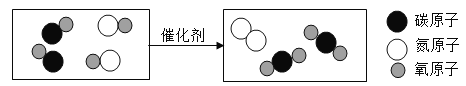
(1)该微观反应过程中出现了_____种氧化物
(2)该反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是
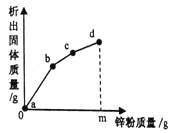
A.c点对应溶液中含有的金属离子为Zn2+和Cu2+
B.bc段(不含两端点)析出的金属是Fe
C.ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+、Fe2+
D.若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,m1>m2
查看答案和解析>>
科目:初中化学 来源: 题型:
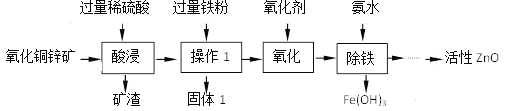
【题目】某科研小组设计利用稀H2SO4浸取某废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解于水)的方案。部分实验流程如下:
已知:①H2O2、KMnO4是常见的氧化剂
②各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请根据上述实验流程回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是_________,写出硫酸溶解氧化锌的化学方程式为_________________。
(2)“操作1”所需要的主要玻璃仪器有______________________,固体1的成分是___________。
(3)“氧化”的目的是将Fe2+反应生成Fe3+,以便在后续的操作中将溶液中铁元素除去从产品纯度的角度分析,氧化剂最好选用_________________(填“H2O2"或“KMnO4”)。
(4)“除铁”过程中加入氨水的目的是通过调节溶液的pH,使Fe3+沉淀而Zn2+不沉淀,pH应控制在_______范围之间。
(5)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com