
将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体.某研究性学习小组对固体沉淀的成分进行了如下探究.请完成下列各题:
(一)猜想与假设:
猜想一:固体为CuCO3,理由: (用化学反应方程式表示).
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈碱性.
猜想三:固体为Cu(OH)2和CuCO3的混合物.
(二)资料查阅:
①结晶水合物受热后易失去结晶水,如CuSO4•5H2O CuSO4+5H2O↑;
CuSO4+5H2O↑;
②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物.
③无水氯化钙可做吸水剂;碱石灰的主要成分为氢氧化钠固体和氧化钙
(三)设计与实验:
Ⅰ.固体的获取:将反应后的固、液混合物经过滤、洗涤、室温晾干得蓝色固体.
Ⅱ.定性探究固体的成分:
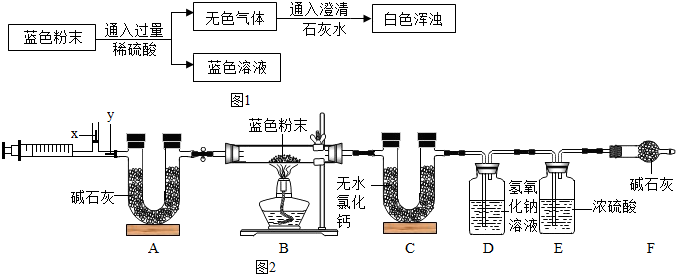
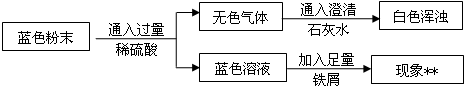
用图1所示方案,进行实验,并得到下列现象:
(1)上图中无色气体为 ,所以猜想二不成立.
(2)向蓝色溶液中加入足量的铁屑,实验现象为 .
发生反应的方程式为 、 .
Ⅲ.定量测定固体的组成:
设固体为aCu(OH)2•bCuCO3•cH2O,为测定其组成,称取24.0g蓝色固体.继续进行实验:
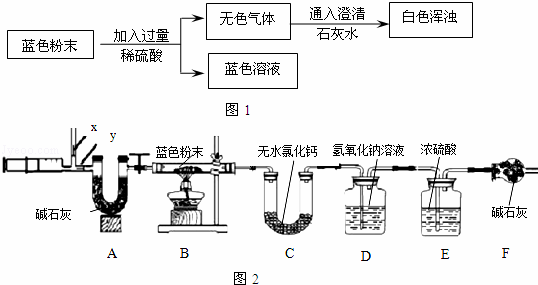
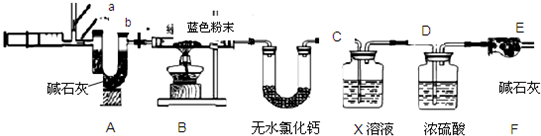
图2中注射器处为两个单向阀:推注射器时x关闭,y处打开;拉注射器时,x打开进空气,y关闭.
实验步骤:①组装好装置,检查气密性;②反复推拉注射器;③称量B、C、D、E、F的质量;④关闭弹簧夹,加热B处玻璃管直到反应不再进行;⑤打开弹簧夹,再次反复缓缓推拉注射器;⑥再次称量B、C、D、E、F的质量.
问题探究:
(3)进行步骤⑤的操作中,注射器活塞要缓缓推动的主要目的是 .
数据处理:
(4)某兴趣小组利用上述方法,测得以下数据:(假定每步反应都完全)
| B | C | D | E | F | |
| 反应前 | 124.0g | 250.0g | 300.0g | 350.0g | 360.0g |
| 反应后 | 116.0g | 253.6g | 304.3g | 350.1g | 360.0g |
E装置质量增加的原因是 ;求该固体的化学式中 a:b:c= .
| (一)猜想一:根据碳酸钠和硫酸铜反应生成蓝色沉淀进行分析 (三)设计与实验:(1)根据二氧化碳的性质考虑;(2)根据方程式的书写方法和生成物来判断;(3)根据步骤⑤的操作目的和推注射器目的考虑;(4)根据E中液体的性质和方程式进行计算考虑;根据反应前后原子种类和个数不变考虑. | |
| 解答: | 解:(一)猜想与假设:反应物是硫酸铜和碳酸钠,生成物是碳酸铜沉淀和硫酸钠;化学方程式为Na2CO3+CuSO4=CuCO3↓+Na2SO4; (三)(1)由于二氧化碳能使澄清石灰水变浑浊,所以无色气体是二氧化碳; (2)由于加入的硫酸是过量的,所以加入铁后,铁与硫酸反应生成硫酸亚铁和氢气;由于前面加入硫酸后生成了硫酸铜,所以加入铁后,铁与硫酸铜反应生成铜和硫酸亚铁;故实验现象为:铁片表面有气泡生成、铁片表面有红色物质生成,反应的化学方程式为Fe+H2SO4=FeSO4+H2↑ Fe+CuSO4=FeSO4+Cu (3)进行步骤⑤的操作,是为了将B中生成气体完全排出(使C、D充分吸收),防止产生误差;该操作中推注射器时缓缓的目的是防止气流过快,C、D不能充分吸收; (4)由于浓硫酸具有吸水性,所以E装置质量增加的原因是有水,气流带出D中水蒸气造成的;无水氯化钙可做吸水剂,所以无水氯化钙质量的增加量就是生成水的质量:253.6g﹣250g=3.6g;根据氧的个数相等:2a+3b+c=a+b+2a+2c+2b解得a=c,再将其带入方程式,推出a=b,所以a:b:c=1:1:1. 故答案为:(一)猜想一:CuSO4+Na2CO3=CuCO3↓+Na2SO4 (三)(1)二氧化碳(CO2) (2)铁片表面有气泡生成、铁片表面有红色物质生成(只答出一点就给分) Fe+H2SO4=FeSO4+H2↑ Fe+CuSO4=FeSO4+Cu Ⅲ.(3)防止气流过快,C、D中气体不能被溶液充分吸收. (4)气流带出D中水蒸气 a:b:c=1:1:1 |


科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| B | C | D | E | F | |
| 反应前 | 124.0g | 250.0g | 300.0g | 350.0g | 360.0g |
| 反应后 | 116.0g | 253.6g | 304.3g | 350.1g | 360.0g |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| B | C | D | E | F | |
| 反应前 | 124.0g | 250.0g | 300.0g | 350.0g | 360.0g |
| 反应后 | 116.0g | 253.6g | 304.2g | 350.2g | 360.0g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com