
【题目】某兴趣小组对石灰石样品进行如下实验分析,取48.0g样品放入质量为100.0g的烧杯中,将150.0g稀盐酸分3次加入烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得烧杯及其内物质的质量记录如下。
次数 | 1 | 2 | 3 |
加入稀盐酸的质量/g | 50.0 | 50.0 | 50.0 |
烧杯及其内物质的质量/g | 190 | 232 | 278 |
请计算:
(1)样品中CO2的质量为_________________g。
(2)所用稀盐酸的溶质的质量分数___________
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】在一烧杯中盛有20g CaCl2和NaCl的混合固体粉末,向其中逐渐滴加溶质的质量分数为10. 6%的Na2CO3溶液,产生沉淀的质量与所滴入Na2CO3溶液的质量关系曲线如图所示。请根据题意回答下列问题:
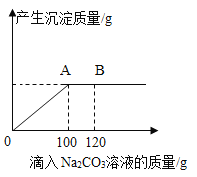
(1)当滴加了120gNa2CO3 溶液时,烧杯中溶液中的溶质是_____________(写化学式)。
(2)当滴加了100gNa2CO3 溶液时,产生沉淀质量为______________g。
(3)当滴加了100gNa2CO3 溶液时,通过计算求此时所得不饱和溶液中溶质的质量分数___(计算结果精确至0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】基本实验与原理分析:
I.根据下图回答问题

(1)仪器a的名称是______________;
(2)选用装置①制氧气的化学方程式为__________;实验室制取二氧化碳选用的装置是______________,检验二氧化碳是否集满的操作是_____________;能用装置③收集的气体具有____________性质。
II.现有固体混合物(硝酸钾、少量氯化钠、泥沙),利用化学实验室常用仪器把硝酸钾从混合物中分离出来。回答下列问题:
(1)分离步骤为:①_____________;②趁热过滤;③冷却结晶;④再过滤;⑤洗涤晶体;⑥干燥晶体;
(2)过滤所用的玻璃仪器有玻璃棒、烧杯和_____________;
(3)趁热过滤的目的是_____________;
(4)洗涤晶体的目的是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
土豆是继水稻、小麦、玉米之后的第四大粮食作物,含淀粉、蛋白质、维生素C等多种营养物质,是餐桌上的美味食材。

表1鲜土豆中主要营养物质的含量(每100g)
蛋白质/g | 脂肪/g | 淀粉/g | 钙/mg | 磷/mg | 维生素C/mg |
1.5-2.3 | 0.4-0.94 | 17.5-28.0 | 11-60 | 15-68 | 20-40 |
土豆切开后发生褐变,用水浸泡能防止褐变,但会引起营养物质流失。用土豆片进行实验,测得其食用品质、淀粉含量和维生素C含量随浸泡时间的变化如下:

土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒,就算是把变绿、发芽的部位削掉,也不宜食用。除食用外,土豆还可以作为原料广泛用于医药、化工、纺织、造纸等工业中。
依据文章内容回答下列问题。
(1)表1中的“钙”指的是______________(填“元素”或“原子”)。
(2)由图1可知:60min内,_________(填序号,下同)。
A 浸泡30min比10min脆性分值高
B 浸泡10min,硬度、咬碎感均无明显变化
C 随着浸泡时间的增加,粘结性、弹性分值均降低
(3)由图2可知:土豆片的淀粉含量与浸泡时间的关系是_______________________。
(4)変绿、发芽的土豆不宜食用,其原因是___________________________________。
(5)下列说法正确的是_____________。
A 土豆是四大粮食作物之一 B 土豆中维生素C含量最高
C 用水泡可防止土豆片褐変 D 土豆开发应用的前景广阔
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A-I是初中常见的纯净物,它们的转化关系如下图,一些反应条件已略去,其中A在常温下是无色液体,可作溶剂,B为单质,E为黑色固体, H为蓝色沉淀。
根据以上信息回答下列问题:

(1)写出E的化学式:________________。
(2)写出反应①的化学方程式________________。
(3)写出反应②的化学方程式________________。
(4)反应③属于________________反应(填基本反应类型)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种物质的溶解度曲线如图所示。下列叙述正确的是
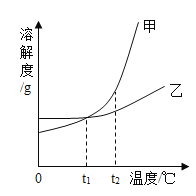
A.依据溶解度曲线可判断,甲的溶解度比乙的大
B.将甲、乙的饱和溶液从t2℃降到t1℃,析出乙的质量大
C.将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法
D.t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请你应用质量守恒定律完成下列各题。
(1)世博会已有千辆新能源汽车投入运行,其中部分公交车采用二甲醚(C2H6O)做燃料。二甲醚分子中C、H、O元素的原子个数比为 。
(2)某化合物在纯氧中充分燃烧后,只生成水和二氧化碳,该物质中 。
A. 只含有碳元素
B. 只有氢元素
C. 一定含有碳、氢两种元素,可能含有氧元素
D. 一定有碳、氢、氧三种元素
(3)黑火药点燃时发生如下反应:2KNO3+S+3C![]() K2S+3CO2↑+X↑,其中X的化学式为 。
K2S+3CO2↑+X↑,其中X的化学式为 。
(4)下图给出的是某反应在同一容器中反应前后的分子种类。
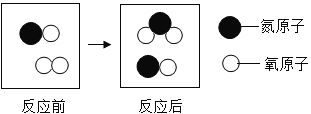
反应前 反应后
①化学反应中,参加反应的![]() 和生成的
和生成的![]() 的质量比为 。
的质量比为 。
②由此可知,在化学反应前后,一定不变的是 (填数字序号)。
a. 原子种类 b. 原子数目 c. 分子种类
d. 分子数目 e. 元素种类 f. 物质的总质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是某化学反应的微观示意图,有关该反应的说法正确的是( )

A. 该反应中丙与丁的分子个数比为4:1 B. 该反应属于化合反应
C. 该反应前后原子的数目发生改变 D. 该反应没有单质生成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学学习小组为了测定某混合物(Na2CO3 与NaOH混合)中碳酸钠的质量分数,进行了如下实验:称取了20g样品配成溶液,然后逐渐加入一定量质量分数为20.8%的BaCl2溶液,充分反应,在此过程中他进行了三次数据测定,结果如下表:
测定次数 | 第1次 | 第2次 | 第3次 |
加入BaCl2溶液的质量/g | 60 | 120 | 150 |
生成沉淀的质量/g | 11.82 | 19.7 | 19.7 |
请分析数据,回答下列问题:
(1)第1次实验后所得溶液中溶质为_________;
(2)求样品中碳酸钠的质量分数____________(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com