
分析 一、碳燃烧生成二氧化碳,高温条件下,二氧化碳和碳反应生成一氧化碳;
一氧化碳可以用作铁的氧化物的还原剂;
碳酸氢铵受热容易分解;
钡离子能和硫酸根离子结合成硫酸钡沉淀,氯离子能和银离子结合成氯化银沉淀;
二、一氧化碳和氧气混合点燃或加热时可能发生爆炸;
二氧化碳能使澄清石灰水变浑浊;
一氧化碳有毒,扩散到空气中会污染环境;
铁的氧化物被完全还原后固体产物是铁;
根据提供的数据可以计算生成物的种类.
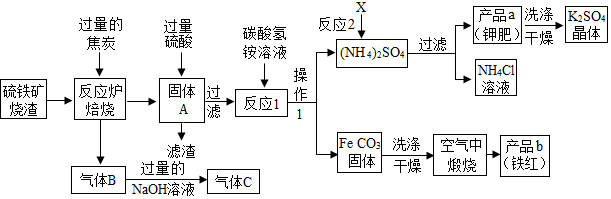
解答 解:(1)气体B中的成分是二氧化碳和一氧化碳.
故填:二氧化碳和一氧化碳.
(2)你认为对气体C最佳的处理方法是再通入反应炉中做反应的还原剂.
故填:C.
(3)反应1的反应温度一般需控制在35℃以下,其目的是防止碳酸氢铵分解.
故填:防止碳酸氢铵分解.
(4)选择KCl的饱和溶液会带入氯离子,选择水时会损失一部分硫酸钾,选择K2SO4的饱和溶液洗涤最好.
故填:C.
为检验K2SO4晶体是否洗涤干净,可取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,
振荡、静置,再向上层清液中加入AgNO3溶液,如果都不产生沉淀,说明洗涤干净.
故填:加入过量的Ba(NO3)2溶液;加入AgNO3溶液.
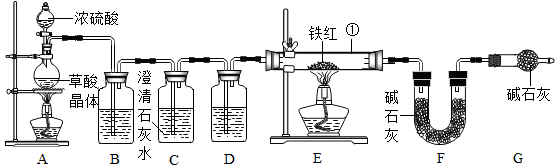
(5)A、E两处酒精灯点燃的先后顺序是先点燃A处,后点燃E处,如果顺序颠倒,可能会导致爆炸.
故填:先点燃A处,后点燃E处.
(6)C装置的作用是检验二氧化碳气体是否除净.
故填:检验二氧化碳气体是否除净.
(7)该装置的缺陷是没有处理尾气.
故填:没有处理尾气.
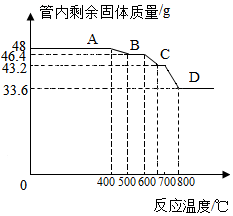
(8)800℃以上时,管内固体成分是铁,铁的化学式是Fe.
故填:Fe.
(9)解:设管内固体的化学式为FexOy,
48g氧化铁中铁元素质量为:48g×$\frac{112}{160}$×100%=33.6g,
氧元素质量为:48g-33.6g=14.4g,
根据题意有:$\frac{33.6g}{46.4g}$=$\frac{56x}{56x+16y}$,
$\frac{x}{y}$=$\frac{3}{4}$,
即46.4g固体是四氧化三铁,即氧化铁和一氧化碳反应生成四氧化三铁和二氧化碳,反应的化学方程式为:
3Fe203+C0$\frac{\underline{\;高温\;}}{\;}$2Fe304+C02.
故填:3Fe203+C0$\frac{\underline{\;高温\;}}{\;}$2Fe304+C02;解:设管内固体的化学式为FexOy,
48g氧化铁中铁元素质量为:48g×$\frac{112}{160}$×100%=33.6g,
氧元素质量为:48g-33.6g=14.4g,
根据题意有:$\frac{33.6g}{46.4g}$=$\frac{56x}{56x+16y}$,
$\frac{x}{y}$=$\frac{3}{4}$,
即46.4g固体是四氧化三铁,即氧化铁和一氧化碳反应生成四氧化三铁和二氧化碳.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:初中化学 来源: 题型:解答题
 同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 反应后固体的质量m∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | A | B | C | D | 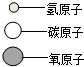 |
| 微观示意图 | 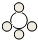 |  | 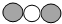 |  |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 熟石灰 石灰石 CaCO3 | B. | 碳酸钠 纯碱 Na2CO3 | ||
| C. | 氧化钙 生石灰CaO | D. | 氢氧化钠 苛性钠NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com