
 ×100%,来计算碳酸钠的质量分数,依据溶解度的定义,由题目中物质的质量关系即可确定其溶解度;
×100%,来计算碳酸钠的质量分数,依据溶解度的定义,由题目中物质的质量关系即可确定其溶解度;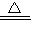 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;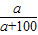 ×100%=
×100%=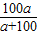 %;由溶解度的定义可知,100g水中最多溶解的溶质质量即是此物质该温时的溶解度,题目水恰为100g溶解的溶质质量为ag,且恰饱和,故此时其溶解度为ag;向溶液中加入足量稀盐酸,有气泡产生,化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
%;由溶解度的定义可知,100g水中最多溶解的溶质质量即是此物质该温时的溶解度,题目水恰为100g溶解的溶质质量为ag,且恰饱和,故此时其溶解度为ag;向溶液中加入足量稀盐酸,有气泡产生,化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.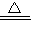 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;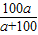 %,a,Na2CO3+2HCl═2NaCl+H2O+CO2↑.
%,a,Na2CO3+2HCl═2NaCl+H2O+CO2↑.

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
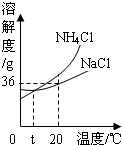 我国著名化学家侯德榜发明的“联合制碱法”的反应原理用化学方程式可简要表示为:
我国著名化学家侯德榜发明的“联合制碱法”的反应原理用化学方程式可简要表示为:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com