
(10分) 某校化学活动小组查阅资料发现,粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质,他们要除去杂质得到精盐,设计了下列实验流程图(序号①~⑧表示实验操作,用于沉淀的试剂稍过量):
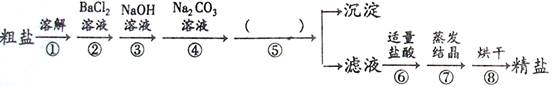
根据上述流程,(回答下列问题:
⑴操作①中玻璃棒的作用是 。
⑵第⑤步操作的名称是 。
⑶“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、酒精灯和 。
⑷实验中加入“Na2CO3溶液”的目的是 。
⑸利用提供的沉淀试剂,再写出一种添加试剂的操作顺序(填序号): 。
(1)搅拌, 加速固体溶解;(2)过滤;(3)蒸发皿;(4)使溶液中氯化钙和氯化钡完全反应;(5)③②④或②④③。
【解析】(1)玻璃棒在溶液中的转动可以加速溶液对氯化钠的冲刷,是粗盐在水中的溶解速率加快.故答案为:搅拌,加速溶解;
(2)过滤是将溶液和不溶性的固体进行分离的一种操作,而经过⑤步的操作后分出了滤液和沉淀两部分.故答案为:过滤;
(3)在对粗盐进行蒸发结晶的过程中,除了题中提供的仪器外,还需要盛放液体进行结晶的装置.故答案为:蒸发皿;
(4)碳酸钠中的碳酸根离子会与钡离子和钙离子反应生成碳酸钡和碳酸钙沉淀;
故答案为:除尽CaCl2、和过量的BaCl2;
(5)添加试剂的操作顺序可以是:③②④或②④③.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源:2010届北京市密云县中考二模化学试卷(带解析) 题型:计算题
(3分)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如下图所示。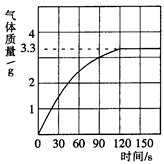
(友情提示: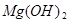 +2HCl=
+2HCl= +H2O)
+H2O)
(1)从图中可以看出,12.5g水垢与盐酸反应后生成的二氧化碳最多是 g。
(2)水垢中碳酸钙的质量分数是多少?
(3)假设水垢中除碳酸钙和氢氧化镁外,不含有其它杂质,溶解12.5 g水垢,至少需要质量分数为10%的盐酸的质量是 (最后结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源:2010届北京市密云县中考二模化学试卷(解析版) 题型:计算题
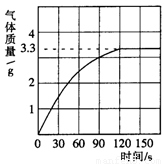
(3分)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如下图所示。
(友情提示: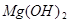 +2HCl=
+2HCl=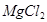 +H2O)
+H2O)
(1)从图中可以看出,12.5g水垢与盐酸反应后生成的二氧化碳最多是 g。
(2)水垢中碳酸钙的质量分数是多少?
(3)假设水垢中除碳酸钙和氢氧化镁外,不含有其它杂质,溶解12.5 g水垢,至少需要质量分数为10%的盐酸的质量是 (最后结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省镇江市丹徒区九年级中考适应性考试化学试卷(解析版) 题型:探究题
(14分)某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【查阅资料】
①该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵。
②生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质。
③生产原理:NaCl+ NH3 + CO2 + H2O= NaHCO3↓+ NH4Cl,分离得晶体A,并使其充分受热,即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为 。
④氯化铵分解的化学方程式是NH4Cl △ NH3↑+HCl↑。
⑤部分生产流程如下图所示:

【问题讨论】
(1)溶液A中的溶质有NaCl和 、 ,操作Ⅱ的名称为 。
(2)上述流程中NaOH溶液的作用是除去粗盐中的 。
(3)写出加入Na2CO3溶液所发生反应的化学方程式 。
(4)上述生产流程中可循环使用的是 (填序号)。
A.CO2 B.NH3 C.HCl D.NaOH
(5)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠:
|
实验步骤 |
实验现象 |
实验结论 |
|
|
|
|
【组成确定】
称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。
(6)由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
同学们为了测定该纯碱样品的纯度(假定只有(6)中的杂质),设计了如下实验:
(7)甲组实验:取10.0 g纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出。充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9 g。计算样品中碳酸钠的质量分数为(写出计算过程,结果保留一位小数)。
(8)乙组实验:取10.0 g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量)。实验结束后,发现乙组测定的碳酸钠质量分数偏小,其原因是 。

查看答案和解析>>
科目:初中化学 来源:2012年江苏省南京市栖霞区中考二模化学试卷(解析版) 题型:探究题
(11分)某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【产品与原理】
该厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:
NaCl(饱和)+ NH3 + CO2 + H2O = NaHCO3↓+ NH4Cl;分离出NaHCO3,加热制得纯碱。
【生产流程】

【相关资料】
⑴ NH4Cl NH3↑+HCl↑
NH3↑+HCl↑
⑵ 已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
|
物质 |
NaCl |
NaHCO3 |
NH4Cl |
NH3 |
CO2 |
|
溶解度 |
36.0g |
9.6g |
37.2g |
710 |
0.9 |
【问题讨论】:
⑴ 操作Ⅰ、Ⅱ的名称为 。
⑵ 反应①中发生了两个反应,写出其中的一个化学方程式:
。
⑶ 反应③中得到纯碱的化学方程式为: 。
⑷ 溶液B中的溶质有 (至少写出两种)。
⑸ 上述生产流程中可循环使用的是 (填序号)。
A.挥发性气体 B.溶液 C.氢氧化镁 D.化肥NH4Cl
【组成确定】
⑴ 称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
⑵ 另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。
由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算并结合右表判断此纯碱样品等级为 品。计算过程:
【总结反思】
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是 。
查看答案和解析>>
科目:初中化学 来源:2011年初中毕业升学考试(四川眉山卷)化学 题型:计算题
(6分)某校化学兴趣小组在老师指导下探究孔雀石(一种铜矿石)的组成元素。他们取50克孔雀石粉末,在密闭容器中加热,观察到孔雀石分解过程中有水和能使澄清石灰水变浑浊的气体产生,绿色的孔雀石逐渐变为黑色粉末(假设:孔雀石中的杂质不反应,生成的二氧化碳全部被石灰水吸收)。在此过程中他们测定了五次,相关数据如下表:
|
测定次数 |
生成沉淀的质量(g) |
生成水的质量(g) |
|
1 |
5 |
0.9 |
|
2 |
10 |
1.8 |
|
3 |
X |
2.7 |
|
4 |
20 |
3.6 |
|
5 |
20 |
3.6 |
请分析数据,回答下列问题:
(1)组成孔雀石的元素有 。
(2)表中“X”的值为 g。
(3)实验最终生成二氧化碳的质量是多少克(写出计算过程)?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com