
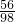 =
=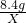
 =
=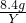
 =
=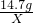
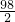 =
=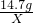
 =
=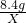


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2003?哈尔滨)如图所示,在托盘天平的两盘上各放一个盛有足量的稀盐酸的烧杯,调节天平至平衡.在左盘烧杯中加入Al和MgCO3的混合物,右盘烧杯中加入Mg和MgO的混合物,且MgCO3与MgO的质量比为21:10,充分反应后,若天平最终仍保持平衡,则加入的Al与Mg两种物质的质量比为
(2003?哈尔滨)如图所示,在托盘天平的两盘上各放一个盛有足量的稀盐酸的烧杯,调节天平至平衡.在左盘烧杯中加入Al和MgCO3的混合物,右盘烧杯中加入Mg和MgO的混合物,且MgCO3与MgO的质量比为21:10,充分反应后,若天平最终仍保持平衡,则加入的Al与Mg两种物质的质量比为查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com