
 科学实验活动册系列答案
科学实验活动册系列答案科目:初中化学 来源: 题型:阅读理解
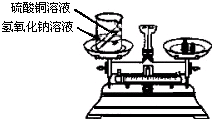 26、在学习了质量守恒定律后,小明和小华来到实验室,他们用如图所示的实验装置,验证了氢氧化钠溶液和硫酸铜溶液反应是符合质量守恒定律的.
26、在学习了质量守恒定律后,小明和小华来到实验室,他们用如图所示的实验装置,验证了氢氧化钠溶液和硫酸铜溶液反应是符合质量守恒定律的.| 阳离子阴离子 | SO42- | NO3- | PO43- | Cl- | CO32- |
| Cu2+ | 溶 | 溶 | 不 | 溶 | 不 |
查看答案和解析>>
科目:初中化学 来源: 题型:
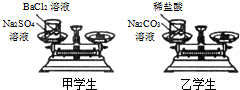 (2006?朝阳区一模)甲、乙学生在学习了“质量守恒定律”后,利用右图所示实验进行探究,以证明其它化学反应也遵守质量守恒定律.他们先使天平平衡,称出烧杯、小试管、药品的总质量,此时指针处于中间位置.然后将小试管里的药品倒入烧杯中,观察现象.待反应完全后,再次称量其总质量.请你与他们一起探究:
(2006?朝阳区一模)甲、乙学生在学习了“质量守恒定律”后,利用右图所示实验进行探究,以证明其它化学反应也遵守质量守恒定律.他们先使天平平衡,称出烧杯、小试管、药品的总质量,此时指针处于中间位置.然后将小试管里的药品倒入烧杯中,观察现象.待反应完全后,再次称量其总质量.请你与他们一起探究:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 二氧化锰 |
| 加热 |
| 二氧化锰 |
| 加热 |
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 | |
| I | 50.0g | 1% | 0.1g | 9mL |
| II | 50.0g | 2% | 0.1g | 16mL |
| III | 50.0g | 4% | 0.1g | 31mL |
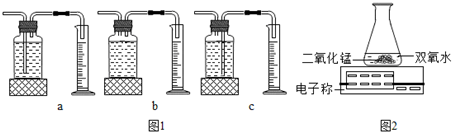
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com