
| 物质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |

分析 本实验探究物质的组成成分以及含量,证明碳酸盐(CO32-检验方法),二氧化碳的化学性质,酸的物理性质及用途,碱的化学性质.
【提出猜想】:根据水垢的成分及题中所给物质的溶解性表可以提出猜想.
【设计方案】:(1)从检验钙离子的方法上入手分析.
(2)a:根据实验操作步骤分析即可;实验室用稀盐酸溶解碳酸钙.
b:碱石灰是碱性干燥剂,可以吸收酸性气体,氢氧化钠可以吸收二氧化碳气体.
c:从二氧化碳的量上去分析.
【实验结论】:根据猜想和计算即可确定水垢的成分.
解答 解:【提出猜想】根据题意可知,水垢的主要成分为碳酸盐、碱等物质的混合物,再结合物质的溶解性表可知,水垢中一定含Mg(OH)2和CaCO3,可能含有Ca(OH)2和MgCO3;
【设计方案】
(1)检验Ca2+要用可溶性的碳酸盐,如Na2CO3溶液,因为二者能反应产生沉淀.
(2)a.由于水垢中存在有碳酸钙,而硫酸与碳酸钙反应会生成微溶于水的硫酸钙,覆盖在碳酸钙的表面,阻止了反应的进一步进行,故溶解碳酸盐一般用稀盐酸;
b.因为该实验是要通过测定生成二氧化碳的质量来确定水垢的成分,而从锥形瓶中出来的二氧化碳气体是不干燥的,且都会被干燥管内的物质吸收,从而影响到结果的测定,所以二氧化碳气体在进入干燥管之前必须经过干燥,浓硫酸恰可以用来干燥二氧化碳气体;由于气压的原因,最后锥形瓶中会残存有一定量的二氧化碳气体,故从导管A处缓缓鼓入一定量的空气吗,可以使装置中的所有二氧化碳都能被碱石灰所吸收.
c.根据化学方程式的计算可知,即使50g水垢全部为CaCO3,产生CO2的质量也仅为22g,而实验测得生成的CO2质量为24g,比22g多,所以水垢中一定还有MgCO3.
【实验结论】实验猜想中已经确定有Mg(OH)2和 CaCO3,而根据(2)的计算可知还应该含有MgCO3,故水垢的主要成分有Mg(OH)2、CaCO3和MgCO3.
故答案为:
【提出猜想】Mg(OH)2; MgCO3;
【设计方案】
(1)Na2CO3溶液;
(2)a.稀盐酸;
b.吸收CO2中的水;使装置中的二氧化碳全部被碱石灰吸收;
c.即使50g水垢全部为CaCO3,产生CO2的质量应为22g,而实验测得生成的CO2质量>22g
【实验结论】Mg(OH)2、CaCO3、MgCO3.
点评 在解此类题时,首先要会分析题中所涉及的反应原理,然后结合反应原理和计算所要用到的数据进行分析解答.对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等.


科目:初中化学 来源: 题型:解答题
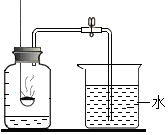 测定空气成分的方法很多,某校化学兴趣小组设计了如图所示的装置.
测定空气成分的方法很多,某校化学兴趣小组设计了如图所示的装置.| 组别 | 1 | 2 | 3 | 4 | 5 | 6 |
| 进入集气瓶中水的体积(ML) | 20 | 19 | 20 | 20 | 22 | 20 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com