
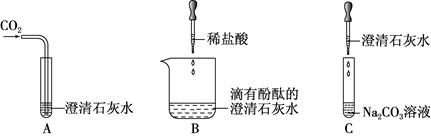


科目:初中化学 来源:不详 题型:实验题
 C+2MgO ②3Mg+N2
C+2MgO ②3Mg+N2 Mg3N2
Mg3N2
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题

A.验证使石蕊变色的物质是碳酸而不是二氧化碳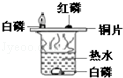 |
B.可燃物燃烧的条件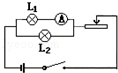 |
C.伏安法测电阻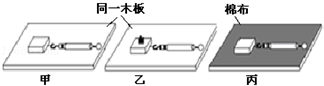 |
| D.研究影响滑动摩擦力大小的因素 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
 2Na2S4+2Na2S2O3+4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。
2Na2S4+2Na2S2O3+4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。
| | 第1次 | 第2次 | 第3次 |
| h1/cm | 11.0 | 11.4 | 11.6 |
| h2/cm | 8.7 | 9.1 | 9.2 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
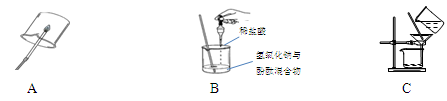
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 20% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
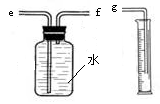
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量铜锈于试管中,加入适量稀硫酸 | 固体溶解,产生气泡,溶液呈蓝色 | 铜锈溶解后形成的溶液中含有的阳离子是 ※ (写化学符号) |
| b.将生成气体通入澄清石灰水 | | 铜锈中含有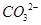 |
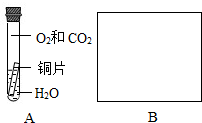
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
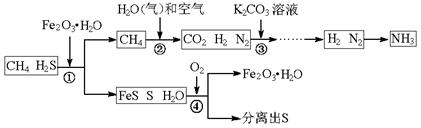


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com