
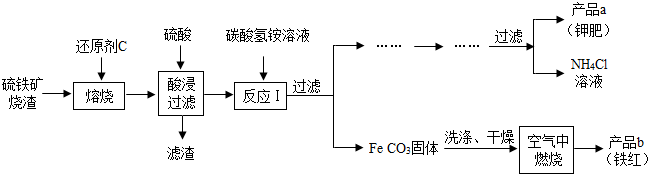
| ||
| ||
| ||
| ||


科目:初中化学 来源: 题型:
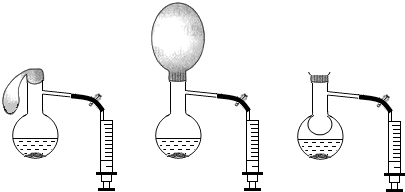 在蒸馏烧瓶内加适量固体X和液体Y,观察气球逐渐胀大.打开弹簧夹,将注射器中液体Z注入烧瓶并振荡,气球缩小并被吸入烧瓶内.则X、Y、Z分别是( )
在蒸馏烧瓶内加适量固体X和液体Y,观察气球逐渐胀大.打开弹簧夹,将注射器中液体Z注入烧瓶并振荡,气球缩小并被吸入烧瓶内.则X、Y、Z分别是( )| X | Y | Z | |
| A | Zn | 稀盐酸 | 石灰水 |
| B | CaO | 水 | 稀盐酸 |
| C | Na2CO3 | 稀硫酸 | NaOH溶液 |
| D | NaOH | 水 | 稀硫酸 |
| A、Zn、稀盐酸、石灰水 |
| B、CaO、水、稀盐酸 |
| C、Na2CO3、稀硫酸、NaOH溶液 |
| D、NaOH、水、稀硫酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、CO2 (H2 ) 通入氧气中点燃后冷却 |
| B、NaCl (Na2SO4 ) 加入适量Ba(NO3)2溶液 |
| C、NaCl 溶液(Na2CO3 ) 加足量稀盐酸加热 |
| D、KCl固体(KClO3)加少量Mn02加热 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 组别 | 物质 | 所含杂质 | 除去杂质的方法 |
| 一 | CO2 | CO | 通过足量氢氧化钠溶液,干燥 |
| 二 | NaCl | 泥沙 | 溶解、过滤、蒸发 |
| 三 | NaOH溶液 | Na2CO3 | 加入适量的氢氧化钙溶液,过滤 |
| 四 | Cu(NO3)2溶液 | AgNO3 | 加入过量的铜粉,过滤 |
| A、第一组 | B、第二组 |
| C、第三组 | D、第四组 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

| ||

查看答案和解析>>
科目:初中化学 来源: 题型:
| 空气 | NH3 | CH4 | HCl | O2 | |
| 密度/g?L-1 | 1.293 | 0.77l | 0.717 | 1.629 | 1.43 |
| 溶解性 | -- | 极易溶 | 难溶 | 极易溶 | 不易溶 |
| A、NH3 |
| B、CH4 |
| C、HCl |
| D、O2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com