
(8分)X是两种金属氧化物组成的混合物,为了研究混合物的成分,进行了如图所示的实验。
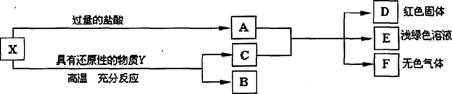
(1)x中含有的金属元素是__ ____(填元素符号)。
(2)写出X中一种成分与盐酸反应的化学方程式:_________ 。
(3)若Y为固体,写出Y与X中一种成分反应的化学方程式 ______________ ;
若Y 为气体,Y还可以是___ ______(填化学式),写出其中一个反应的化学方程式:
。
(1)Fe、Cu(1分)
(2)6HCl+ Fe2O3 === 2FeCl3+ 3H2O或2HCl+ CuO === CuCl2+ H2O (2分)
(3)3C+2Fe2O3 4Fe + 3CO2
4Fe + 3CO2 或C + 2CuO
或C + 2CuO  2Cu+ CO2
2Cu+ CO2 ; (2分)
; (2分)
H2、CO;(1分)3CO + Fe2O3 2Fe + 3CO2或CO + CuO
2Fe + 3CO2或CO + CuO  Cu+ CO2 (2分)
Cu+ CO2 (2分)
【解析】(1)X是两种金属氧化物组成的混合物,与过量的盐酸反应,所得的A中含有多余的盐酸,金属氧化物能被还原性物质还原为相应的金属,得到的C与A混合,得到的E为浅绿色溶液,则E为氯化亚铁,反应后的到的D是红色固体,则D可能是铜,铁能与亚酸反应生成氢气,则F可能是氢气,所以X中含有的金属元素是铁元素和铜元素,所以本题答案为:Fe,Cu;
(2)X中含有氧化铜,能与盐酸反应生成氯化铜和水,所以本题答案为:6HCl+ Fe2O3 === 2FeCl3+ 3H2O或CuO+2HCl═CuCl2+H2O;
(3)Y为固体,则Y为碳,能与氧化铜反应生成铜和二氧化碳,Y为气体,可以是一氧化碳或氢气,所以本题答案为:3C+2Fe2O3 4Fe + 3CO2
4Fe + 3CO2 或C + 2CuO
或C + 2CuO  2Cu+ CO2
2Cu+ CO2 ;
;
CO、H2; 3CO + Fe2O3 2Fe + 3CO2或CO + CuO
2Fe + 3CO2或CO + CuO  Cu+ CO2 。
Cu+ CO2 。


科目:初中化学 来源: 题型:
| 二氧化锰 |
| 加热 |
| 二氧化锰 |
| 加热 |
| 试验编号 | 实验药品 | 分解温度/℃ |
| ① | 氯酸钾 | 580 |
| ② | 氯酸钾、二氧化锰(质量比1:1) | 350 |
| ③ | 氯酸钾、氧化铜(质量比1:1) | 370 |
| ④ | 氯酸钾、Fe2O3(质量比1:1) | 390 |
| 过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | 二氧化锰的质量 |
相同时间内产生VO2 | |
| ① | 50.0g | 1% | 0.1g | 9ml |
| ② | 50.0g |
2% | 0.1g | 16ml |
| ③ | 50.0g |
4% | 0.1g | 31ml |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com