
| 烧杯中可能出现的现象 | 结 论 |
| ①有黑色不溶物,无气泡逸出,溶液不变色 | 只含 C |
| ② | 含 C、CuO |
| ③有黑色不溶物,有气泡逸出,溶液呈浅绿色 | 含 |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| A、溶液质量增大,溶质质量分数增大 |
| B、溶液质量减小,溶质质量分数减小 |
| C、溶液质量增大,溶质质量分数减小 |
| D、溶液质量减小,溶质质量分数增大 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、在氢气中,氢显+1价 |
| B、在化合物里,铁一定显+2价 |
| C、金属在化合物里常显正价 |
| D、非金属在化合物里一定显负价 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、“热冰”与水的物理性质不同 |
| B、“热冰”在任何条件下都不会融化 |
| C、“热冰”与水的化学性质不同 |
| D、结成“热冰”后,分子停止运动 |
查看答案和解析>>
科目:初中化学 来源: 题型:
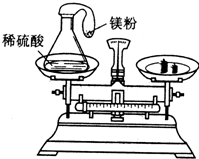 某学生在课外研究性学习活动课上用如图所示的装置做实验,瓶内放了足量的硫酸,可充气的气球放有一定量的镁粉,将它紧紧套在瓶口上,放在托盘天平上称量,质量为W1,然后将气球内的镁粉全部倒入瓶内,立即产生气体(H2SO4+Mg═MgSO4+H2 ),气体逐渐胀大,充分反应后最终再次称量,质量为W2,结果W1>W2,试分析:
某学生在课外研究性学习活动课上用如图所示的装置做实验,瓶内放了足量的硫酸,可充气的气球放有一定量的镁粉,将它紧紧套在瓶口上,放在托盘天平上称量,质量为W1,然后将气球内的镁粉全部倒入瓶内,立即产生气体(H2SO4+Mg═MgSO4+H2 ),气体逐渐胀大,充分反应后最终再次称量,质量为W2,结果W1>W2,试分析:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com