
分析 根据锌、铜的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出锌的质量,进而计算混合物中铜的质量.
解答 解:(1)产生氢气的质量是 154.7 g+8g-162.5=0.2g.
(2)参加反应的锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.2g
$\frac{65}{x}=\frac{2}{0.2g}$
x=6.5g
混合物中铜的质量是8g-6.5g=1.5g
答:(1)产生氢气的质量是0.2g;(2)混合物中铜的质量是1.5g.
点评 本题难度不大,掌握根据化学方程式与溶质质量分数的综合计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将游码向左移动 | B. | 减少砝码 | C. | 加适量的食盐 | D. | 调节平衡螺母 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
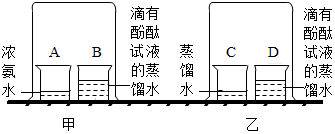 某兴趣小组做如图实验探究分子有运动.请回答实验中的有关问题.
某兴趣小组做如图实验探究分子有运动.请回答实验中的有关问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com