
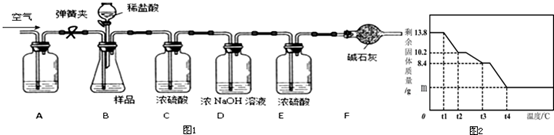
| B | C | D | E | F | |
| 反应前 | 122.0g | 250.0g | 300.0g | 350.0g | 330.0g |
| 反应后 | 120.6g | 250.2g | 301.0g | 350.1g | 332.0g |
分析 (1)根据实验目的分析实验步骤;
(2)根据二氧化碳与碳酸镁晶体的质量关系进行分析;
(3)根据实验目的分析氢氧化钠溶液的作用;
(4)根据操作步骤引起的二氧化碳质量的变化分析对n值的影响;
(5)根据图象分析晶体分解过程、以及书写化学方程式.
解答 解:(1)有气体生成的装置必须先检查装置的气密性,通过碳酸镁晶体与盐酸反应产生二氧化碳的质量确定n的值,实验前应将装置中的二氧化碳排净,因此先将除去二氧化碳的空气鼓入装置,要除去空气中二氧化碳,可将空气通过氢氧化钠溶液吸收,然后关闭弹簧夹a,打开分液漏斗活塞,缓缓滴入稀盐酸至不再产生气体为止,打开弹簧夹a,缓缓鼓入空气,使产生的二氧化碳全部排到C装置中,C装置增重的质量即为生成的二氧化碳的质量;
(2)3次实验C装置平均增重:$\frac{1.1g+1.11g+1.09g}{3}$=1.1g,
MgCO3•nH2O~CO2
84+18n 44
3.45g 1.1g
$\frac{84+18n}{3.45g}$=$\frac{44}{1.1g}$
解得:n=3;
(3)由上述分析可知A装置内盛的是氢氧化钠溶液,以吸收空气中的二氧化碳,防止对生成二氧化碳质量的干扰;
(4)①反应结束后,没有通空气,产生的二氧化碳没有全部排到C装置,使二氧化碳的质量偏小,引起结果偏大;
②滴入稀盐酸前,没有通空气,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小;
③没有A装置,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小;
④D装置中NaOH溶液浓度过大,不会影响二氧化碳的质量,对结果没有影响;
⑤稀盐酸滴加速率太快,产生的二氧化碳没有全部被C装置吸收,使二氧化碳的质量偏小,引起结果偏大;
⑥没有C装置,水蒸气会进入D装置中,使二氧化碳的质量偏大,引起结果偏小;
(5)①通过分析可知,t1℃至t2℃时,剩余固体质量不变的原因为:没有达到该晶分解需要的温度;
②由第(2)问计算可知该晶体的化学式为MgCO3•3H2O,由图象可知该晶体分解过程先分解生成水,当结晶水全部失去后碳酸镁分解生成氧化镁和水,设t2℃时,剩余固体化学式为MgCO3•xH2O,则此时分解的化学方程式为
MgCO3•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•xH2O+(3-x)H2O
138 84+x×18
13.8g 10.2g
$\frac{138}{13.8g}$=$\frac{84+18x}{10.2g}$
x=1
所以t1℃至t2℃时MgCO3•nH2O分解的化学方程式为:MgCO3•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•H2O+2H2O;
③根据分解过程可知最终分解过程是碳酸镁完全分解生成氧化镁和水,因此最终固体是氧化镁,化学式为MgO,所以
MgCO3•3H2O----MgO
138 40
13.8g 4g
所以完全反应后,剩余固体的质量m为4g.
故答案为:(1)①检查装置的气密性,⑤鼓入一段时间空气;
(2)n=3;
(3)NaOH(浓)溶液;
(4)①⑤,②③⑥;
(5)①没有达到该晶分解需要的温度;
②MgCO3•3H2O═MgCO3•H2O+2H2O;
③4g.
点评 本题考查通过分析实验数据测定物质组成,要注意保证产生的二氧化碳全部被吸收,同时要排除装置内空气中的二氧化碳进入C装置.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:初中化学 来源: 题型:选择题
| A. | 反应后固体物质的组成中一定有银、铜、镁,可能有锌 | |
| B. | 向滤液中滴加NaCl溶液,可能与不溶于稀HNO3的白色沉淀生成 | |
| C. | 反应后固体物质中一定有银、铜、锌、镁 | |
| D. | 滤液中一定含有Mg2+,可能含有Zn2+ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
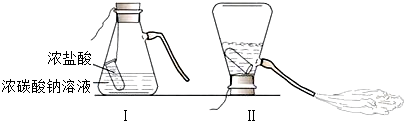
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量废液滴加少量硝酸银溶液 | 有白色沉淀产生 |
| ② | 另取适量废液,加入少量氧化铜 | 黑色粉末逐渐溶解,溶液逐渐变成蓝色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
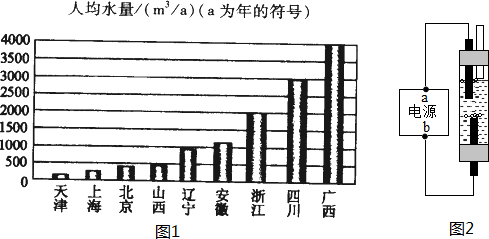
| 紧 缺 性 | 轻度缺水 | 中度缺水 | 重度缺水 | 极度缺水 |
| 人均水量(m3/a) | 1700-3000 | 1000-1700 | 500-1000 | <500 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫在氧气中燃烧发出明亮蓝紫色火焰 | |
| B. | 浓盐酸敞口放置在空气中瓶口猫“白雾” | |
| C. | 铁丝在氧气中燃烧生成白色固体四氧化三铁 | |
| D. | 红磷在氧气中燃烧产生白烟 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 实验室里有一瓶标签残缺的试剂瓶,标签中只剩下“Na”和“10%”字样(如图所示),某兴趣小组对其组成员进行如下探究.
实验室里有一瓶标签残缺的试剂瓶,标签中只剩下“Na”和“10%”字样(如图所示),某兴趣小组对其组成员进行如下探究.| 物质 | NaHCO3 | NaCl | NaOH | Na2CO3 |
| 溶解度g/100g水 | 9.6 | 36 | 109 | 215 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
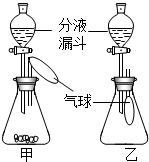 某化学兴趣小组设计了一组“吹气球”实验,装置如图:
某化学兴趣小组设计了一组“吹气球”实验,装置如图:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
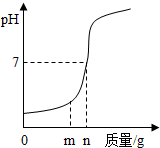 (1)用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示.熟石灰与盐酸反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H20;当加入熟石灰m g时,溶液中的溶质为CaCl2和HCl.若改用n g氢氧化钠与相同量盐酸反应,所得溶液的pH<7(填“>”“<”或“=”).
(1)用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示.熟石灰与盐酸反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H20;当加入熟石灰m g时,溶液中的溶质为CaCl2和HCl.若改用n g氢氧化钠与相同量盐酸反应,所得溶液的pH<7(填“>”“<”或“=”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com