
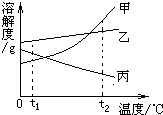
 如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在),请根据下图回答:
如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在),请根据下图回答: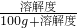 ×100%,所以溶解度大的溶质质量分数就大,降温到t1℃时乙的溶解度大于甲的,所以乙溶液的溶质质量分数大于甲的,因为丙降温后溶解度增大,变为不饱和溶液,溶质质量分数不变,因为t1℃时甲的溶解度大于丙物质在t2℃时的溶解度,所以降温后溶液中溶质的质量分数由大到小的顺序为乙>甲>丙;
×100%,所以溶解度大的溶质质量分数就大,降温到t1℃时乙的溶解度大于甲的,所以乙溶液的溶质质量分数大于甲的,因为丙降温后溶解度增大,变为不饱和溶液,溶质质量分数不变,因为t1℃时甲的溶解度大于丙物质在t2℃时的溶解度,所以降温后溶液中溶质的质量分数由大到小的顺序为乙>甲>丙;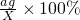 ═1%;
═1%;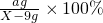 ═2%,解得这两个方程组可求出X=18g.
═2%,解得这两个方程组可求出X=18g.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:初中化学 来源: 题型:


查看答案和解析>>
科目:初中化学 来源: 题型:
 如图是甲、乙、丙三种固体(均不含结晶水)的溶解度曲线.20℃时,烧杯中分别盛有相同质量的甲、乙、丙饱和溶液,各加入等质量的对应固体,并升温至40℃,观察到,甲固体逐渐减少至全部溶解,下列判断正确的是( )
如图是甲、乙、丙三种固体(均不含结晶水)的溶解度曲线.20℃时,烧杯中分别盛有相同质量的甲、乙、丙饱和溶液,各加入等质量的对应固体,并升温至40℃,观察到,甲固体逐渐减少至全部溶解,下列判断正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com