
【题目】绿矾(FeSO4·7H2O)是一种重要的食品添加剂。某工厂产生的炉渣主要含有FeO和Fe2O3,还有一定量的SiO2(SiO2不溶于水、不与稀硫酸反应)。实验室以此炉渣制备绿矾的流程如下:

(1)步骤①实验时需用到的玻璃仪器是___________、玻璃棒和烧杯。该过程发生反应的化学方程式为:①FeO+H2SO4=FeSO4+H2O,②__________________。
(2)滤液A中含有的溶质有FeSO4、_______________。
(3)加入试剂X的目的是将Fe3+转化为Fe2+,试剂X可用SO2或Fe。
①若试剂X是SO2,转化原理为SO2+Fe2(SO4)3+2H2O=2FeSO4+2Y,则Y的化学式是__________。
②若试剂X是Fe,转化原理为Fe+ Fe2(SO4)3=3FeSO4。测得反应后溶液的pH明显增大,其原因是__________________。
(4)步骤③的操作是蒸发浓缩、___________、过滤,即得到绿矾晶体。
【答案】漏斗 ![]() Fe2(SO4)3、H2SO4 H2SO4 铁消耗过量硫酸,溶液酸性减弱,所以pH增大 冷却结晶(或结晶)
Fe2(SO4)3、H2SO4 H2SO4 铁消耗过量硫酸,溶液酸性减弱,所以pH增大 冷却结晶(或结晶)
【解析】
(1)步骤①实现了固液分离,故步骤①是过滤,过滤需用到的玻璃仪器是:烧杯、漏斗、玻璃棒;
向炉渣中加入过量稀硫酸,FeO与稀硫酸反应生成硫酸亚铁和水,该反应的化学方程式为:![]() ,三氧化二铁与稀硫酸反应生成硫酸铁和水,该反应的化学方程式为:
,三氧化二铁与稀硫酸反应生成硫酸铁和水,该反应的化学方程式为:![]() ;
;
(2)FeO与稀硫酸反应生成硫酸亚铁和水,三氧化二铁与稀硫酸反应生成硫酸铁和水,且稀硫酸过量,故滤液A中含有的溶质有FeSO4、Fe2(SO4)3、H2SO4;
(3)①根据质量守恒定律,化学反应前后,原子的种类和数目不变,结合化学方程式: ![]() ,反应前硫原子是4个,反应后应该是4个,其中2个包含在2Y中,反应前氧原子是16个,反应后应该是16个,其中8个包含在2Y中,反应前后铁原子都是2个,反应前氢原子是4个,反应后应该是4个,包含在2Y中,则Y的化学式是:H2SO4;
,反应前硫原子是4个,反应后应该是4个,其中2个包含在2Y中,反应前氧原子是16个,反应后应该是16个,其中8个包含在2Y中,反应前后铁原子都是2个,反应前氢原子是4个,反应后应该是4个,包含在2Y中,则Y的化学式是:H2SO4;
② 若试剂X是铁,铁能与过量的稀硫酸反应生成硫酸亚铁和氢气,溶液酸性减弱,所以pH增大,故填:铁消耗过量硫酸,溶液酸性减弱,所以pH增大;
(4)硫酸亚铁溶液通过步骤③变成FeSO4·7H2O晶体,故步骤③为蒸发浓缩、冷却结晶、过滤。


科目:初中化学 来源: 题型:
【题目】利用如图装置进行气体的制取实验,请回答下列问题:
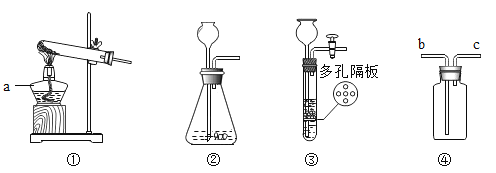
(1)写出标号仪器的名称:a_____,
(2)用氯酸钾制取氧气的文字表达式______________。
(3)选择④装置收集氧气,气体从_____(填字母)端进入.若改用排水法收集,实验结束后先撤导气管后熄灭酒精灯,目的是防止________________.
(4)实验室选用加热一种暗紫色固体制取氧气,应选用装置__________,但应对该装稍做改进,即:____________,该反应的文字表达式为:____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学方程式解释下列化学事例:
(1)生活中铝制品能够防腐______________;
(2)建房子时用石灰浆刷过墙壁一段时间后会变硬___________;
(3)石灰石高温煅烧得到生石灰______________;
(4)氢气是一种很清洁的能源__________;
(5)沼气燃烧的化学方程式为_________________;
(6)镁条投入稀盐酸产生大量气泡_____________;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室制取气体的常用装置,请回答下列实验问题。
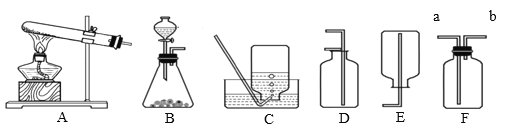
(1)装置C、D、E、F在实验室中都可收集气体,其中不能用来收集氧气的是_____(填字母编号)。若用F装置收集二氧化碳,气体应从_____(填“a”或“b”)端通入。
(2)英国化学家布莱克是第一个“捕捉”到CO2的人,实验室制备CO2的化学方程式为_____,1774年德国化学家贝格曼将CO2通入紫色石蕊试液中,发现试液由紫色变为_____色。
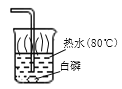
(3)将产生的氧气通入如图烧杯中,可观察到白磷燃烧起来,说明白磷燃烧需要的条件是_____。
(4)加热氯酸钾和二氧化锰的固体混合物制取氧气,充分反应后,利用下列流程回收反应后的固体。
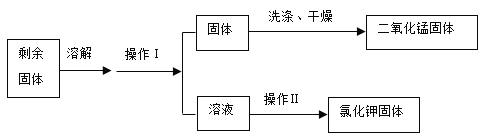
①加热氯酸钾和二氧化锰的混合物制取氧气的化学方程式为_____。
②操作Ⅰ的名称是_____,操作Ⅰ和操作Ⅱ都用到的玻璃仪器是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科学家利用四氧化三钴(Co3O4)纳米棒催化剂,将汽车尾气中的CO在低温下氧化为CO2(如图所示)。下列关于该反应的说法正确的是
![]()
A.该反应属于置换反应
B.反应后氧原子数目比反应前减少
C.反应前后Co3O4的化学性质发生变化
D.可有效降低汽车尾气对大气的污染
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下表信息,相关说法正确的是( )

A.20℃时,NaCl 的溶液度为 36.0
B.40℃时,KCl 饱和溶液的溶质质量分数为 40%
C.40℃时,向 100g 水中加入 50gNH4Cl 充分溶解,溶液质量为 145.8g
D.60℃时降温到 20℃时,KNO3 和 KCl 的饱和溶液析出晶体较多的是 KNO3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】电动汽车所用电池生产和回收的管理不当也会污染环境,处理不当会导致人体血铅超标。化学电池是一类重要的能源,铅酸蓄电池是一种可充电的二次化学电池,其反应的原理用化学方程式表示为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。则回答:
2PbSO4+2H2O。则回答:
(1)铅酸蓄电池放电时能量转变是化学能转变成____能。
(2)某铅酸电池厂生产电池用的28%的稀硫酸,将98%浓硫酸稀释配制成该稀硫酸时,正确的操作是_____________,并不断搅拌以防液体飞溅。
(3)使用铅酸蓄电池的电动车与使用汽油燃料的轻便摩托车相比,电动车的突出优点是不会产生____等温室气体,但电池对土壤和水体的污染也是不容忽视,因此要回收再利用废旧电池。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】常温下,氯气(Cl2)能溶于水,并能部分与水反应生成盐酸和次氯酸(HClO)。次氯酸能杀死水中的细菌,所以自来水厂常用氯气消毒。
(1)写出Cl2与H2O反应的化学方程式:_________。
(2)若用Cl2消毒过的自来水配制10%的下列溶液,溶质质量分数不受影响的是________(填序号)。
A稀盐酸 B烧碱溶液 C稀硫酸 D硝酸钾溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验。
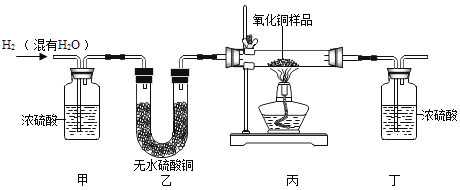
(1)实验中,乙装置的作用是_____。
(2)准确称取完全反应前后装置丙和丁的质量如表:
装置丙 | 装置丁 | |
反应前 | 48.8克 | 161.2克 |
反应后 | 46.5克 | 163.9克 |
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度_____(写出计算过程)。
(3)根据以下原因计算,可能导致结果偏大的是_____。
A 装置的气密性不好
B 空气中的水分被丁处浓硫酸吸收
C 通入的氢气量不足
D 空气中的二氧化碳被丁处浓硫酸吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com