
��̼���ƣ�2Na2CO3��3H2O2���㷺����ϴ�ӡ���֯��ҽ�ơ���ֽ�ȡ�ij��ȤС��չ���������ѧϰ��
�����Ͽ�Ƭ����
���Ʊ��о�����ͼ���Ʊ���̼���ƵĹ������̡�
��ش����⣺
��1����Ӧ���з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2�������У���Ӧ����������ڽϵ��¶��½��У�ԭ���� ��
��3�����������У������϶��NaCl���Ա��̼���ƾ���������������Ϊ ��
��4������A�������� ������ʵ������ɴ˲�������Ҫ�IJ����������ձ��� �� ��
��5��ϴ�ӹ�̼���ƾ������ѡ�� ��
A������ˮ B����ˮ�ƾ� C������̼������Һ D������NaCl��Һ
��6��ĸҺ����ѭ��ʹ�ã�������Ҫ���е������� �� ��
���Ȳⶨ���ⶨ��̼������Ʒ�����ʲ�����ˮ����2Na2CO3��3H2O2������������
С��ͬѧ���������ͼ��ʾʵ��װ�ã�����������ȥ����������ʵ�顣
��ʵ�鲽�衿���� ���ڽ���̼������Ʒ��2.20g����������ɫ��ĩ���Ȼ�Ϻ�����װ��A�У�����Ͳ�м���ˮ����������������Һ©����������������ˮ���ܴ�װ��A�� ʱ��ֹͣ�μ�ˮ�����رջ������ݴ���Ͳ��ˮ�治�ٱ仯ʱ����¼����ˮ��̶ȣ��������ݽ��м��㡣
��ʵ����������ݴ�������
��7������ʵ�鲽���������ݣ��� ���� ��
��8��ʵ���У�ˮ�������� ����ɫ��ĩ�ܼӿ��̼���Ƶķֽ����ʣ������������ͻ�ѧ�����ڷ�Ӧǰ������䣬������ ���ѧʽ����
��9��ʵ���У� ����ʼ�ռ����壻��2�֣�
A���տ�ʼ��������ʱ B�������ݾ�����������ʱ
C�����ô�����ľ�����ڵ��ܿڲ�����ȼʱ
��10������Ͳ���ռ�������������224mL��ͨ������£��������ܶȽ���Ϊ1.43g��L��1�����������̼������Ʒ��2Na2CO3��3H2O2������������3�֣�Mr��2Na2CO3��3H2O2��=314��Mr��O2��=32�� ��
��ʵ�鷴˼����
��11���������ۣ�С��ͬѧһ����Ϊ�ⶨ���ƫ����ԭ���� ��
��12����Ͳ�г����ܵ������� ��
��13����ͬѧ�����װ����ԭ�п�����ʹ�ⶨ���ƫ������˵���Ƿ���ȷ���粻��ȷ����˵�����ɡ� ��
��14���������ۣ�С��ͬѧһ����Ϊ���������������вⶨ����������װ��A��ʣ������ˣ�ϴ������������ϴ��Һ������Һ��������ˮ����1.39g������Ʒ��2Na2CO3��3H2O2����������Ϊ ��
��15���������Ͽ�Ƭ���㻹����Ƴ�ʲô�����ⶨ��Ʒ��2Na2CO3��3H2O2������������ ����ֻ�������Ҫ�ķ�����
��1��2Na2CO3+3H2O2=2Na2CO3��3H2O2 ��2����ֹ��̼���Ʒֽ⣬Ӱ������Ͳ���
��3����̼������NaCl��Һ���ܽ�Ƚ�С������������
��4������ ������ ©�� ��5��B ��6��NaCl Na2CO3����H2O2��
��7����������� ���ٲ�������ʱ ��8���ܽ��̼���ƣ�������ֽ� MnO2����CuO��
��9��A��2�֣�
��10��95.0��
��11�������ˮռ������ƿ�ڵ������ʹ��O2���ƫ��
��12�������ã���ֹ�¶Ƚ���������ʱ�������������ƫ����������
��13������ȷ��װ����ԭ�п��������ɵ�O2��������� ��ע��������������ȷ�����֣�
��14��93.6������93.5����
��15���뷽�������̼���ƺ��ᷴӦ����CO2��������������������м��㣨���̼���ƺ��Ȼ��ơ��Ȼ�������Һ���ɳ����������вⶨ��������������Ҳ�ɵ÷֣�
���������������1�������Ʊ���̼���ƵĹ�������ͼ��֪����Ӧ���еķ�Ӧ����Na2CO3��Һ��H2O2��Һ�����������Ʊ��Ĺ�̼���ƣ��ʷ�Ӧ�Ļ�ѧ����ʽΪ2Na2CO3+3H2O2=2Na2CO3��3H2O2��
��2���������Ͽ�Ƭ��֪����̼���Ʋ��ȶ������ȡ���ˮ�ֽ⣬��Ϊ�˷�ֹ��̼���Ʒֽ⣬Ӱ������Ͳ��ʣ��������У���Ӧ����������ڽϵ��¶��½��С�
��3�������������������϶��NaCl����ʹ��̼���ƾ���������˵����ͬ�¶��£���̼������NaCl��Һ�е��ܽ�ȣ�Ҫ����ˮ�е��ܽ��С����Һ���״ﵽ������״̬���о���������
��4������ͼʾ��֪������A�ǽ�ĸҺ�Ͳ�����ĸҺ�ľ�����뿪���IJ�������Ϊ���ˣ�������Ҫ����������Ȼ��Ҫ©����ͬʱ����Ҫ������������
��5�����ڹ�̼���Ʋ��ȶ�����ˮ�ֽ⣬��ϴ�ӹ�̼���ƾ���ʱ�����漰��ˮ���������ѡ����ˮ�ƾ�����ѡB��
��6������ͼʾ��֪��Ϊ����ʹ��̼���ƾ�������������Һ�м����˴�����NaCl����ĸҺ��һ������NaCl�����⣬��ĸҺ��Na2CO3��ĸҺ����ΪNa2CO3�ı�����Һ������Һ��һ������Na2CO3��
��7���ٸ������⣬Ҫ���ø�װ����ȡ���ռ�����������Ҫװ�ò���©�������Է�ӦǰҪ���װ�õ������ԣ��ܵ�A�в��ٲ�������ʱ��˵����̼��������ȫ��Ӧ�������ټ�ˮ��
��8���������⣬��̼���Ʋ��ȶ�����ˮ�ֽ⣬���Լ�ˮ�ܴٽ���ֽ⣬ͬʱˮ���ܽ��̼���ƣ�������������ĽӴ��棬���ӷ�Ӧ�����ʣ�
�������⣬��ɫ��ĩ�ܼӿ��̼���Ƶķֽ����ʣ��������������ͻ�ѧ�����ڷ�Ӧǰ������䣬�ʸú�ɫ��ĩ�Ǹ÷�Ӧ�Ĵ������ʿ�����MnO2����CuO����
��9���������ݲ���ʱ��˵����Ӧ�Ѿ���ʼ����Ҫ�����ռ�����ѡA
��10�����ݹ�ʽ���㣬��̼���Ʒֽ������������=224mL��10��3��1.43g/L��1 = 0.32g��
���̼������Ʒ��2Na2CO3��3H2O2������Ϊx
2(2Na2CO3��3H2O2) =4Na2CO3 + 6H2O + 3O2��
628 96
x 0.32g
628��96=x��0.32g
���x=2.09g
����Ʒ�У�2Na2CO3��3H2O2����������=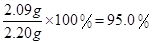
��11�����ڵ����ˮռ������ƿ��һ�����������ʹ��O2���ƫ��
��12���������Ͽ�Ƭ��֪����̼���ƷֽⷴӦ�����л�ų������������ɵ��������������ͣ�������Ӧ�����¶Ƚ���������ʱ��װ����ѹǿ��С������ʱ���ڳ����ܵĿ�������ˮ�����ϣ��ʿɷ�ֹ������
��13������ȷ����Ϊװ����ԭ�еĿ������ڷ�Ӧ��ʼʱ��������Ͳ��������ѹǿ��ԭ�����װ�����Իᱣ��һ�������ɵ����������൱��װ����ԭ�п��������ɵ�O2�����������
��14���������Ͽ�֪��2(2Na2CO3��3H2O2) = 4Na2CO3 + 6H2O + 3O2��������ȫ��Ӧ�����Һ�е�������Na2CO3�����Խ�װ��A��ʣ������ˣ�ϴ��������������������ϴ��Һ������Һ�������õ���1.39g��ˮ���弴ΪNa2CO3�����������
���̼������Ʒ��2Na2CO3��3H2O2������Ϊx
2(2Na2CO3��3H2O2) =4Na2CO3 + 6H2O + 3O2��
628 424
x 1.39g
628��424=x��1.39g
���x=2.06g
����Ʒ�У�2Na2CO3��3H2O2����������=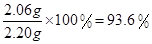
��15���������Ͽ�Ƭ��֪����̼���ƾ���̼���Ƶ����ʣ��ʿɼ�����䷴Ӧ������취�����̼���ƺ��ᷴӦ����CO2��������������������м��㡣
���㣺������Һ�Ͳ�������Һ�����ˣ���д��ѧ����ʽ��ʵ��̽�����ʵ���ɳɷ��Լ��������εĻ�ѧ���ʣ����ݻ�ѧ��Ӧ����ʽ�ļ���
������������֤��ʵ��̽����Ҫ������ʵ����ʻ�仯���ɣ����ݸ�����ʵ����Ʒ���������ʵ�顢������̽������ͨ���۲졢��¼�ͷ�����ʵ����������֤�����ʵ����ʻ�仯���ɵȡ�


 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д� Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �������õ�����Ư������ѧ���ϣ���ʦ����һ�ֳ�����Ư�������ʣ�������˫��ˮ��H2O2������̼���ƣ�2Na2CO3?3H2O2���������ƣ�CaO2���е�һ�֣�ͬѧ�ǹ۲췢�֣���Ư��Ϊ��ɫ��ĩ����ͼ����
�������õ�����Ư������ѧ���ϣ���ʦ����һ�ֳ�����Ư�������ʣ�������˫��ˮ��H2O2������̼���ƣ�2Na2CO3?3H2O2���������ƣ�CaO2���е�һ�֣�ͬѧ�ǹ۲췢�֣���Ư��Ϊ��ɫ��ĩ����ͼ����| ʵ�鲽�� | ʵ����� | ʵ������ | ���� |
| ����1 | ȡ2g��ɫ��������Թ��У�����5mLˮ������� | Һ����ǣ��г�����ϸС����ð���� | |
| ����2 | ����1���Թ��м����μ���ɫ��̪�� | ��ɫ��̪��죮 | |
| ����3 | �����μ� |
��Ư���ijɷֲ��ǹ�̼���ƣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �������õ�����Ư������ѧ���ϣ���ʦ����һ�ֳ�������ϵƯ�������ʣ�������˫��ˮ��H2O2������̼���ƣ�2Na2CO3?3H2O2���������ƣ�CaO2���е�һ�֣�ͬѧ�ǹ۲췢�֣���Ư��Ϊ��ɫ��ĩ����ͼ����
�������õ�����Ư������ѧ���ϣ���ʦ����һ�ֳ�������ϵƯ�������ʣ�������˫��ˮ��H2O2������̼���ƣ�2Na2CO3?3H2O2���������ƣ�CaO2���е�һ�֣�ͬѧ�ǹ۲췢�֣���Ư��Ϊ��ɫ��ĩ����ͼ����| ʵ�鲽�� | ʵ����� | ʵ������ | ���� |
| ����1 | ȡ2g��ɫ��������Թ��У�����20mLˮ������� | Һ����ǣ� �г�����ϸС����ð���� |
|
| ����2 | ���ã�ȡ����1���Թ��ϲ���Һ�������μ���ɫ��̪�� | ��ɫ��̪��죮 | |
| ����3 | ���������ijɷֲ��ǹ�̼���ƣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �������õ�����Ư������ѧ���ϣ���ʦ����һ�ֳ���Ư�������ʣ�������˫��ˮ��H2O2������̼���ƣ�2Na2CO3?3H2O2���������ƣ�CaO2���е�һ�֣�ͬѧ�ǹ۲췢�֣���Ư��Ϊ��ɫ��ĩ����ͼ����
�������õ�����Ư������ѧ���ϣ���ʦ����һ�ֳ���Ư�������ʣ�������˫��ˮ��H2O2������̼���ƣ�2Na2CO3?3H2O2���������ƣ�CaO2���е�һ�֣�ͬѧ�ǹ۲췢�֣���Ư��Ϊ��ɫ��ĩ����ͼ����| ʵ�鲽�� | ʵ����� | ʵ������ | ���� |
| ����1 | ȡ2g��ɫ��������Թ��У�����5mlˮ������� | Һ����ǣ� �г�����ϸС����ð���� |
|
| ����2 | ����1���Թ��м����μ���ɫ��̪�� | ��ɫ��̪��죮 | |
| ����3 | ���������ijɷֲ��ǹ�̼���ƣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1����̼���ƾ���̼���ƺ��������˫�����ʣ����ȶ������ȡ���ˮ�ֽ⣻ 2����̼���Ʒֽ�Ļ�ѧ����ʽΪ2��2 Na2CO3?3 H2O2 ��=4 Na2CO3+6 H2O+3O2�� 3��H2O2�ֽ�ų�������Na2CO3���Ȳ��ֽ⣻���Ʊ��о�����ͼ1���Ʊ���̼���ƵĹ������̣�  ��ش����⣺ ��1����Ӧ���з�����Ӧ�Ļ�ѧ����ʽΪ 2Na2CO3+3H2O2�T2Na2CO3?3H2O2 2Na2CO3+3H2O2�T2Na2CO3?3H2O2 ����2�������У���Ӧ����������ڽϵ��¶��½��У�ԭ���� ��ֹ��̼���Ʒֽ⣬Ӱ������Ͳ��� ��ֹ��̼���Ʒֽ⣬Ӱ������Ͳ��� ����3�����������У������϶��NaCl���Ա��̼���ƾ���������������Ϊ ��̼������NaCl��Һ���ܽ�Ƚ�С������������ ��̼������NaCl��Һ���ܽ�Ƚ�С������������ ����4������A�������� ���� ���� ������ʵ������ɴ˲�������Ҫ�IJ����������ձ��������� ������ ��©�� ©�� ����5��ϴ�ӹ�̼���ƾ������ѡ�� B B ��A������ˮ B����ˮ�ƾ� C������̼������Һ D������NaCl��Һ ��6��ĸҺ����ѭ��ʹ�ã�������Ҫ���е������� NaCl NaCl ��Na2CO3����H2O2�� Na2CO3����H2O2�� �����Ȳⶨ���ⶨ��̼������Ʒ�����ʲ�����ˮ����2Na2CO3?3H2O2������������ С��ͬѧ�������ͼ2��ʾʵ��װ�ã�����������ȥ����������ʵ�飮 [ʵ�鲽��]���� ��������� ��������� ���ڽ���̼������Ʒ��2.20g����������ɫ��ĩ���Ȼ�Ϻ�����װ��A�У�����Ͳ�м���ˮ����������������Һ©����������������ˮ���ܴ�װ��A�����ٲ������� ���ٲ������� ʱ��ֹͣ�μ�ˮ�����رջ������ݴ���Ͳ��ˮ�治�ٱ仯ʱ����¼����ˮ��̶ȣ��������ݽ��м��㣮[ʵ����������ݴ���]�� ��7������ʵ�鲽���������ݣ��� ��������� ��������� �������ٲ������� ���ٲ������� ����8��ʵ���У�ˮ�������� �ܽ��̼���ƣ�������ֽ� �ܽ��̼���ƣ�������ֽ� ����ɫ��ĩ�ܼӿ��̼���Ƶķֽ����ʣ������������ͻ�ѧ�����ڷ�Ӧǰ������䣬������MnO2����CuO�� MnO2����CuO�� ���ѧʽ������9��ʵ���У� A A ����ʼ�ռ����壻A���տ�ʼ��������ʱ B�������ݾ�����������ʱ C�����ô�����ľ�����ڵ��ܿڲ�����ȼʱ ��10������Ͳ���ռ�������������224mL��ͨ������£��������ܶȽ���Ϊ1.43g?L-1�����������̼������Ʒ��2Na2CO3?3H2O2����������[Mr��2Na2CO3?3H2O2��=314��Mr��O2��=32] 95% 95% ��[ʵ�鷴˼]�� ��11���������ۣ�С��ͬѧһ����Ϊ�ⶨ���ƫ����ԭ���� �����ˮռ������ƿ�ڵ������ʹ��O2���ƫ�� �����ˮռ������ƿ�ڵ������ʹ��O2���ƫ�� ����12����Ͳ�г����ܵ������� �����ã���ֹ�¶Ƚ���������ʱ�������������ƫ���������� �����ã���ֹ�¶Ƚ���������ʱ�������������ƫ���������� ����13����ͬѧ�����װ����ԭ�п�����ʹ�ⶨ���ƫ������˵���Ƿ���ȷ���粻��ȷ����˵�����ɣ� ����ȷ��װ����ԭ�п��������ɵ�O2��������� ����ȷ��װ����ԭ�п��������ɵ�O2��������� ����14���������ۣ�С��ͬѧһ����Ϊ���������������вⶨ����������װ��A��ʣ������ˣ�ϴ������������ϴ��Һ������Һ��������ˮ����1.39g������Ʒ��2Na2CO3?3H2O2����������Ϊ 93.6% 93.6% ����15���������Ͽ�Ƭ���㻹����Ƴ�ʲô�����ⶨ��Ʒ��2Na2CO3?3H2O2������������ �뷽�������̼���ƺ��ᷴӦ����CO2��������������������м��㣨���̼���ƺ��Ȼ��ơ��Ȼ�������Һ���ɳ����������вⶨ �뷽�������̼���ƺ��ᷴӦ����CO2��������������������м��㣨���̼���ƺ��Ȼ��ơ��Ȼ�������Һ���ɳ����������вⶨ ����ֻ�������Ҫ�ķ�����
�鿴�𰸺ͽ���>> ��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ����� ��̼���ƣ�2Na2CO3?3H2O2���㷺����ϴ�ӡ���֯��ҽ�ơ���ֽ�ȣ�ij��ȤС��չ���������ѧϰ�� �����Ͽ�Ƭ����
|