(2013?镇江模拟)兴趣小组参观某制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl
2和CaCl
2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH
3+CO
2+H
2O=NaHCO
3↓+NH
4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH
4Cl
NH
3↑+HCl↑.
④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:

【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式
2NaOH+MgCl2═Mg(OH)2↓+2NaCl;
2NaOH+MgCl2═Mg(OH)2↓+2NaCl;
.
②操作Ⅱ的名称为
过滤
过滤
.
③反应(1)中加适量盐酸的作用是
除去过量的氢氧化钠和碳酸钠
除去过量的氢氧化钠和碳酸钠
.
④反应(2)中为提高产率,所加气体的顺序是
B
B
(填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是
D
D
(填字母).
A.CO
2 B.NH
3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为
.
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

| 选择的装置 |
实验现象 |
实验结论 |
AB AB |
B中澄清石灰水不变浑浊 B中澄清石灰水不变浑浊 |
样品不含晶体A |
【组成探究二】
(4)取纯碱样品加水溶解,向其中加入过量稀HNO
3,再滴加AgNO
3溶液,有白色沉淀.产生沉淀的方程式为
AgNO3+NaCl═AgCl↓+NaNO3
AgNO3+NaCl═AgCl↓+NaNO3
,确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:
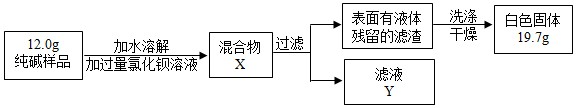
①判断加入BaCl
2溶液是否过量的合适方法是
A
A
,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl
2溶液
B.向滤液Y中滴加BaCl
2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加
BC
BC
,观察现象判断.
A.BaCl
2溶液 B.稀H
2SO
4 C.Na
2CO
3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为
88.3%
88.3%
(写出计算过程)






 (2013?镇江模拟)仔细观察右边的漫画后回答:
(2013?镇江模拟)仔细观察右边的漫画后回答: (2013?镇江模拟)用“○”和“●”分别代表两种不同元素的原子,这两种元素组成的物质在一定条件下能发生反应,反应前后的微观模拟图如下.下列说法正确的是( )
(2013?镇江模拟)用“○”和“●”分别代表两种不同元素的原子,这两种元素组成的物质在一定条件下能发生反应,反应前后的微观模拟图如下.下列说法正确的是( )