
| 序号 | 1 | 2 | 3 | 4 |
| 加稀硫酸的质量/g | 14.00 | 14.00 | 14.00 | 14.00 |
| 剩余物质的质量/g | 23.96 | 37.92 | 51.88 | 65.88 |
分析 (1)根据金属活动性,铜不与硫酸反应,说明所剩余固体全部为铜,则可知铜的质量6.10g,根据表格中的数据可知氢气的质量;
(2)利用前三次反应所消耗硫酸的质量,由反应中金属质量与硫酸质量关系,计算出金属的相对原子质量,根据金属的相对原子质量判断金属;
根据反应的化学方程式,由硫酸质量计算生成硫酸盐的质量、放出氢气的质量,硫酸盐的质量与反应后溶液质量比可计算所得溶液中溶质的质量分数;其中反应后溶液质量可利用质量守恒定律计算求得.
解答 解:(1)铜不与硫酸反应,根据实验数据可知,样品中铜的质量为6.10g,合金中铜与另一金属的质量比为6.10g:(10.00g-6.10g)=61:39,根据表格中的数据可知,实验中生成H2的总质量为0.12g;
(2)(取到第三次的实验数据为准)设M金属单质的相对原子质量为x.
参加反应的金属的质量=10.0g-6.1g=3.9g.而参加反应的硫酸溶液的质量为14g×3=42g.
M+H2SO4═MSO4+H2↑
x 2
3.9g 0.12g
则$\frac{x}{2}=\frac{3.9g}{0.12g}$,解得x=65,因此该金属是锌.(也可选取第一次或第二次实验的数据计算)
(3)设该稀硫酸中溶质的质量分数为y.
Zn+H2SO4═ZnSO4+H2↑
98 2
42.0g×y 0.12g
则$\frac{98}{2}=\frac{42.0gy}{0.12g}$,解得y=14%
故答案为:
(1)61:39;0.12g;(2)锌;14%.
点评 根据质量守恒定律,第三次加入硫酸充分反应后,所得溶液的质量=参加反应金属的质量+前三次所加稀硫酸的质量-放出氢气的质量.


科目:初中化学 来源: 题型:解答题
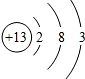 铝在工业和日常生活中应用广泛.请回答:
铝在工业和日常生活中应用广泛.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
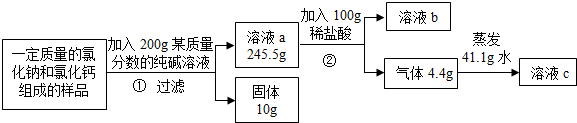
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 现有稀硫酸、碳酸钾溶液、氯化钡溶液、氢氧化钙溶液、氧化铁、镁带六种物质,请回答问题:
现有稀硫酸、碳酸钾溶液、氯化钡溶液、氢氧化钙溶液、氧化铁、镁带六种物质,请回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 目前人类所使用的能源绝大部分来自太阳能 | |
| B. | 化石燃料蕴藏的能量来自于远古时期生物体所吸收的太阳能 | |
| C. | 光合作用和呼吸作用均是大自然利用太阳能成功的范例 | |
| D. | 光-电转换把太阳能直接转换成电能 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
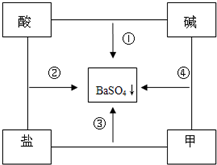
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com