
分析 (1)根据二氧化碳的质量算出碳酸钠的质量,再用碳酸钠的质量除以样品的质量解答即可;
(2)根据二氧化碳的质量计算出生成的氯化钠的质量,再加上原来的氯化钠质量,除以反应后总溶液质量即可解答.
解答 解:(1)设12g纯碱样品中含Na2CO3的质量为x,生成NaCl 的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 4.4 g
则$\frac{106}{x}=\frac{117}{y}=\frac{44}{4.4g}$,解得x=10.6g,y=11.7g
该纯碱样品中含Na2CO3的质量分数为:$\frac{10.6g}{12.0g}$×100%=88.3%
(2)反应后所得溶液中NaCl 的质量为:12g-10.6g+11.7g=13.1g,溶液中NaCl的质量分数为:$\frac{13.1g}{57.9g+12g-4.4g}$×100%=20%;
故答案为:(1)88.3%;(2)20%;
点评 解答本题容易出错的地方是计算反应后所得溶液中NaCl 的质量分数时,容易忽略原来的氯化钠质量.


科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
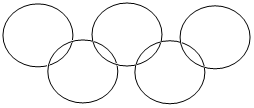 今年是“奥运年”“奥运在我心中”.全世界人们将欢聚里约,相互学习与交流.整理归纳物质性质之间的相互联系是学习化学的一种有效方法.请你从学习过的单质、氧化物、酸、碱、盐中分别选一种代表物(不能重复选用),用化学式填写在如图的奥运标志五圆环中(两环相连表两种物质之间能相互发生反应).
今年是“奥运年”“奥运在我心中”.全世界人们将欢聚里约,相互学习与交流.整理归纳物质性质之间的相互联系是学习化学的一种有效方法.请你从学习过的单质、氧化物、酸、碱、盐中分别选一种代表物(不能重复选用),用化学式填写在如图的奥运标志五圆环中(两环相连表两种物质之间能相互发生反应).查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 目的 | 方案 |
| A | 分离NaCl和CaCO3的混合物 | 溶解,过滤,蒸发滤液 |
| B | 比较金属镁和铝的活动性 | 将镁条和铝粉分别放入等质量、等浓度的盐酸中 |
| C | 除去CO2中的CO | 将混合气体通过足量的氢氧化钠溶液、干燥 |
| D | 除去NaOH溶液中的Na2CO3 | 滴加稀盐酸,直到无气泡产生 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 温度 溶解度盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 小于50mL | B. | 大于50mL | C. | 等于50mL | D. | 无法判断 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com