


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解
 (2013?克拉玛依二模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图)的溶液,他们对此产生了兴趣.
(2013?克拉玛依二模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图)的溶液,他们对此产生了兴趣.| 方法 | 实验操作 | 实验现象 | 实验结论 |
| 一 | 取少量样品于试管中,慢慢滴加BaCl2溶液,静置一段时间,倾去上层清液,向沉淀中继续滴加稀盐酸 | 先出现白色沉淀,后产生大量气泡 | 该瓶无色溶液是 Na2CO3 Na2CO3 . |
| 二 | 取该瓶溶液,慢慢滴加 盐酸 盐酸 溶液 |
产生气泡 | 该瓶无色溶液是Na2CO3.反应的化学方程式是 2HCl+Na2CO3═2NaCl+CO2↑+H2O 2HCl+Na2CO3═2NaCl+CO2↑+H2O . |
| 三 | 取少量样品于试管中,慢慢滴加MgSO4溶液 | 产生 白色沉淀 白色沉淀 |
该瓶无色溶液是 Na2CO3. |
| 经查阅资料得知上述五种盐里碳酸钠、碳酸氢钠的溶液呈碱性,其余三种盐的溶液呈中性,请你再设计一种实验方法,确定该溶液究竟是哪种盐. | |||
| 四 | 取少量样品于试管中,滴加滴加2至3滴酚酞 取少量样品于试管中,滴加滴加2至3滴酚酞 |
溶液变红 | 该瓶无色溶液是 Na2CO3. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
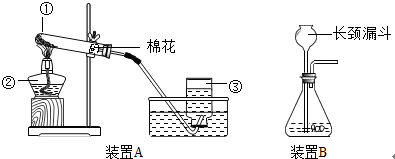
| 加热 |
| 实验操作 | 实验现象 | 实验结论 |
| 取实验后的滤渣放入试管中,加入适量浓盐酸并加热 | 滤渣逐渐溶解,有黄绿色气体生成,同时能闻到刺激性气味 滤渣逐渐溶解,有黄绿色气体生成,同时能闻到刺激性气味 |
滤渣仍为二氧化锰 |
| 二氧化锰 |
| 二氧化锰 |
| 加热 |
| 加热 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 二氧化锰与氯酸钾的质量比 |
|
|
|
|
|
|
|
|
| ||||||||||||||||||
| 生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
| 验实 号编 |
试剂 | 前 10min 内产生 的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
查看答案和解析>>
科目:初中化学 来源:2013-2014学年山东省九年级下学期第一次学情检测化学试卷(解析版) 题型:探究题
某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。参与他们进行的探究活动:
【提出问题】久置氢氧化钠固体的成分是什么?
【猜想与假设】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3; 猜想Ⅲ: 。
【实验与探究】
(1)分析:暴露在空气中的氢氧化钠会变质,变质原因是(用化学方程式表示)______________________
(2)实验如下:
|
实验操作步骤 |
实验现象 |
结论及解释 |
|
步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的_________。 |
实验过程中始终没有气泡产生。 |
则证明猜想 成立。 |
|
步骤二:另取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液。 |
实验过程中产生
|
则证明猜想Ⅱ或Ⅲ成立。此过程中发生反应的化学方程式为 _____________________ |
(3)为了进一步的验证猜想结果,小明同学提出如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想_________成立;若酚酞不变红,则猜想______成立。
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈 性(填“酸”或“碱”),能使酚酞变红,因此他认为该方案的操作步骤中应该改进的是 。
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水,充分振荡 | ________ | 猜想a、c不成立,猜想b成立. |

| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 检查装置的气密性. 向装置中加入药品. | 装置的气密性良好. | |
| ② | 打开分液漏斗活塞,向A 装置中缓慢加入稀盐酸. | A装置中观察到的现象有________, C装置中有气泡出现. | A装置中发生反应的化学方程式为________; C装置作用是________. |
| ③ | 一段时间后用带火星的木条在D内进行检验. | 带火星的木条复燃. | 过氧化钠与二氧化碳反应并生成氧气. |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com