
【题目】美国普度大学研发出一种制备氢气的新工艺,流程如下图所示.下列说法错误的是( )
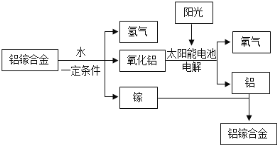
A. 铝镓合金可以循环使用
B. 流程中的氧化铝、水和氧气都属于氧化物
C. 太阳能的利用可以部分解决能源危机问题
D. 铝镓合金与水反应的化学方程式为:2Al+3H2O ![]() Al2O3+3H2↑
Al2O3+3H2↑
科目:初中化学 来源: 题型:
【题目】用化学方程式或化学式填空:
(1)二氧化碳转化为一氧化碳___________
(2)红磷燃烧____________
(3)二氧化碳气体通入到紫色石蕊溶液中,加热后红色又变为紫色,加热液体变紫色的化学方程式为_____
(4)干冰_______
(5)金刚石______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定混有少量杂质的高锰酸钾固体样品中高锰酸钾的质量分数,取20g样品加热(杂质不反应),剩余固体的质量与加热时间的关系如表所示:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
剩余固体质量/g | 20 | 20 | 19.6 | 18.8 | 18.6 | 18.4 | 18.4 |
(1)t0至t1时间段,固体质量不变的原因是____________________________。
(2)反应中产生氧气的质量是_________。
(3)求样品中高锰酸钾的质量分数_________。
(4)该反应中转化为氧气的氧元素质量占高锰酸钾中氧元素质量的________%。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在Fe、H2O、H2、O2、KMnO4五种物质中,按要求各写出一个反应的化学方程式。
(1)化合反应: _____________________________________________________
(2)分解反应:_____________________________________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我市东临渤海,有着丰富的海洋资源。请思考下列问题:
(1)已知东营盐场测得:①海水中含NaCl约为3.5%。②在海边打深井,井水中含NaCl约为8%。晒盐最好用_____(填序号)作原料。
(2)关于晒盐原理的说法正确的是
A.利用阳光和风力,使水分燕发,析出盐
B.日光照晒后,板化钠的溶解度变小
(3)海水晒盐提取食盐晶体后留下的母液叫卤水,其中含有的KCl、MgCl2、MgSO4等物质可作为重要的化工原料。它们的溶解度曲线如右图所示。
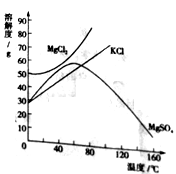
①60℃ 时,将50g硫酸镁加入到100g水中,充分搅拌,所得溶液的溶质质量分数为______,若使其形成饱和溶液,可采取的措施有____。
A.增加溶质 B.蒸发溶剂 C.升高温度 D.降低温度
② 对卤水中含有的KCl、MgCl2、MgSO4三种物质,下列说法正确的是_____
A.三种物质均为易溶物质
B.20℃时,向40gKCl固体和40gMgCl2固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
C.60℃时,三种物质溶于水形成的溶液浓度可能相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组欲验证草酸晶体(H2C2O4·2H2O)的热分解产物,请你参与过程分析。探究过程如下:
(查阅资料)
(1)已知草酸晶体(H2C2O4·2H2O)是一种无色晶体,100℃开始失水,101.5℃左右分解产生H2O、CO和CO2,反应方程式为:H2C2O4·2H2O![]() CO↑+ CO2↑+3H2O。
CO↑+ CO2↑+3H2O。
(2)浓硫酸具有吸水性,常用作气体干燥剂。
(3)白色的无水硫酸铜遇水蒸气变蓝色。
(实验设计)用下图所示装置进行实验(装置C、F中澄清石灰水足量)
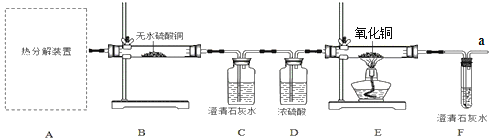
(问题讨论)
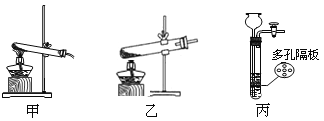
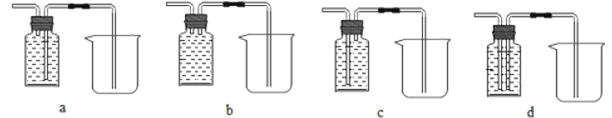
(1)下列可用作A中草酸晶体热分解装置的是________(填“甲”或“乙”或“丙”)。
(2)该兴趣小组进行上述实验时,先点燃热分解装置中的酒精灯,一段时间后再点燃E处的酒精灯,原因是________。
(3)实验过程中观察到:B中白色无水CuSO4变成蓝色,C和F中澄清石灰水均变浑浊,E中____(填实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO2、CO ,E中反应方程式是___。
(4)若通过F装置中澄清石灰水变浑浊来证明草酸晶体热分解的气体产物中有CO,则需在C和D装置之间增加盛有澄清石灰水的洗气瓶,其作用是__________。
(5)从环保角度考虑,该套实验装置有明显缺陷,其改进方式为________。
(继续探究)
(6)兰兰把E中生成的铜与稀硫酸混合加热,发现加热沸腾一段时间后,溶液开始变成淡蓝色,同时产生较多的气泡,生成的是什么气体呢?她猜想①可能是H2 ;②可能是NO2 ;③可能是SO2 ,亚亚认为猜想_________(填序号)一定是错误的,理由是_______。
(7)该小组同学认为a导管尾气中的一氧化碳可以利用,于是将a导管与下列装置连接,除去尾气中的二氧化碳并收集一氧化碳,准备进行后续地探究,其中最合理的装置是______。(填“a、b、c、d”,瓶内为氢氧化钠溶液,能吸收尾气中的CO2)。
(定量分析)
(8)如果有1.4克一氧化碳与E中足量的氧化铜完全反应,生成的气体完全被F中足量的石灰水充分吸收,可得到沉淀多少克______?(请写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工业废液中含有CuSO4、ZnSO4、FeSO4,如果将废液直接排放就会造成水污染.于是几位同学设计实验处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如下:

请回答:
(1)操作①的名称是_____.需要的玻璃仪器有烧杯、________ 、玻璃棒。
(2)步骤①中加入过量M的化学式_________.请写出工业上用赤铁矿(主要成分为Fe2O3)炼铁的化学方程式____________.
(3)若加入一定量M(不考虑上述实验过程中后续实验现象和结论),则滤液A中一定含有的溶质的化学式是_________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碱式碳酸镁[Mg2(OH)2CO3]和过氧化镁(MgO2)都是重要化工原料。
Ⅰ.以Mg2(OH)2CO3为原料,制备产品MgO2的步骤如下:
(1)煅烧:高温煅烧Mg2(OH)2CO3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊,煅烧时反应的化学方程式为________。
(2)转化:向所得固体中加双氧水充分搅拌,发生反应MgO + H2O2 = MgO2+H2O,温度升高,说明该反应________热量(填“放出”或“吸收”)。其他条件相同,煅烧温度、煅烧时间不同,所得MgO对MgO2产率(![]() )的影响分别如图1所示,则最佳的煅烧温度为________℃、煅烧时间_______小时。
)的影响分别如图1所示,则最佳的煅烧温度为________℃、煅烧时间_______小时。

(3)分离:得到产品。
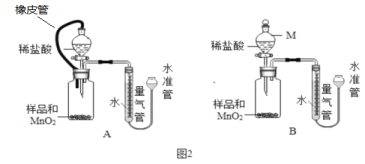
(4)测定:假设产品中仅少量MgO,某小组设计图2装置,通过测定生成O2体积,计算MgO2的质量分数.
已知:a. MnO2与稀盐酸不反应 b. MgO2+2HCl = MgCl2+H2O2
c. 2MgO2![]() 2MgO+O2↑ d. MgO+C
2MgO+O2↑ d. MgO+C![]() Mg+CO↑
Mg+CO↑
①仪器M 的名称是_______________,MnO2的作用是__________。
②相同条件下,装置______能使测定结果更准确。(填图2 中“装置A”或“装置B”)
③经讨论,该小组又设计了下列2种方案,分别取5.0g产品进行实验,能确定MgO2质量分数的是__________(填序号)。
a.加热,使MgO2完全分解,测出剩余固体的质量
b.与足量炭粉在高温下充分反应,测出生成Mg的质量
Ⅱ.MgCl2是制备Mg2(OH)2CO3的原料,工业上通常用碳酸镁来制备MgCl2,反应如下:MgCO3 + Cl2 + CO![]() MgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的碳酸镁多少吨_____?(写出计算过程)。
MgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的碳酸镁多少吨_____?(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据甲酸甲酯(C2H4O2)的化学式计算:
(1)C2H4O2的相对分子质量为______________
(2)C2H4O2中各元素的质量比为______________
(3)C2H4O2中碳元素的质量分数为_______________
(4)实验测得由甲酸甲酯(C2H4O2)、甲酸乙酯(C3H6O2)组成的混合物中碳元素的质量分数是43.2%,求氧元素的质量分数为__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com