
| 实验序号 | 实验过程 | 实验现象 |
| 1 | 镁粉和铁粉分别与5%盐酸反应 | 镁粉产生气体快 |
| 2 | 铁粉和铁片分别与15%盐酸反应 | 铁粉产生气体快 |
| 3 | 铁片分别与5%盐酸和15%盐酸反应 | 15%盐酸产生气体快 |
分析 (1)根据实验现象可以判断相关方面的问题;
(2)根据锌比铜活泼,铜比银活泼,将一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中时,硝酸银先和锌反应生成硝酸锌和银,当锌完全反应后,硝酸银再和铜反应生成硝酸铜和银进行解答.
解答 解:(1)由此得出影响金属与酸反应快慢的因素有:
①:金属活动性,活动性越强,反应速率越快;
②:金属与酸的接触面,接触面越大,反应越快;
③:酸的浓度,酸的浓度越大,反应越快.
故填:金属活动性,活动性越强,反应速率越快;金属与酸的接触面,接触面越大,反应越快;
(2)①锌和硝酸银溶液反应生成硝酸锌和银,反应的化学方程式是:Zn+2AgNO3═Zn(NO3)2+2Ag.
故填:Zn+2AgNO3═Zn(NO3)2+2Ag.
②若滤液为蓝色,说明铜和硝酸银反应生成了硝酸铜,则滤液中一定含有的金属离子是Zn2+、Cu2+.
故填:Zn2+、Cu2+.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


科目:初中化学 来源: 题型:选择题
| A. | 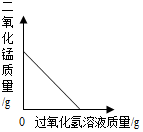 向一定量的二氧化锰中加入过氧化氢溶液 | |
| B. |  加热一定量的高锰酸钾固体 | |
| C. | 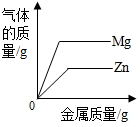 向两份完全相同的稀盐酸中分别加入锌粉、镁粉 | |
| D. | 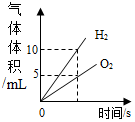 将水通电电解一段时间 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将l0g氯化钠溶于l00g水中,得到质量分数为l0%的氯化钠溶液 | |
| B. | 配制硝酸铵溶液的过程中,溶液的温度会下降 | |
| C. | 配制溶液时,只能用水作溶剂 | |
| D. | 配制50g质量分数为l0%的NaCl溶液时,要用l00mL的量筒量取水 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 二氧化碳:能灭火但会造成酸雨 | |
| B. | 煤:可用作燃料但燃烧会造成空气污染 | |
| C. | 氧气:可供人呼吸但会使食物变质 | |
| D. | 一氧化碳:可用于冶炼金属但会使人中毒 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 具有强还原性 | B. | 常温下化学性质稳定 | ||
| C. | 具有吸附性 | D. | 具有氧化性 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 生石灰作干燥剂 | B. | 干冰用作制冷剂 | ||
| C. | 稀盐酸作除锈剂 | D. | 碳酸氢钠用于治疗胃酸过多症 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com