
某同学加热2~3 mL蒸馏水,操作的正确顺序应该是
①点燃酒精灯 ;②加热;③用试管夹夹好试管; ④往试管里加2~3 mL 蒸馏水;
⑤将试剂瓶盖好,放回原处,标签朝外。
| A.①④③②⑤ | B.④⑤③①② | C.①③④②⑤ | D.④③⑤①② |
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:初中化学 来源: 题型:
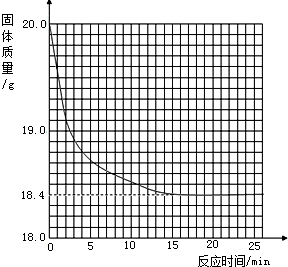 有一黑紫色的固体为KMnO4和MnO2的混合物,为测定混合物中KMnO4的质量分数,某同学取样20.0g,对固体充分加热,测得固体质量随反应时间变化的曲线见下图.
有一黑紫色的固体为KMnO4和MnO2的混合物,为测定混合物中KMnO4的质量分数,某同学取样20.0g,对固体充分加热,测得固体质量随反应时间变化的曲线见下图.| 20.0g-M | 20.0g |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?峨边县二模)某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5g化肥样品与足量浓烧碱溶液加热,产生的氨气用100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如右图所示.所涉及的反应为:(NH4)2SO4+2NaOH═Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4═(NH4)2SO4.请计算:
(2012?峨边县二模)某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5g化肥样品与足量浓烧碱溶液加热,产生的氨气用100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如右图所示.所涉及的反应为:(NH4)2SO4+2NaOH═Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4═(NH4)2SO4.请计算:查看答案和解析>>
科目:初中化学 来源: 题型:
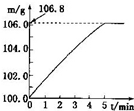 (2011?和平区二模)某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5g化肥样品与足量浓烧碱溶液加热,产生的氮气用100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如图所示,所涉及的反应为:(NH4)SO4+2NaOH=Na2SO4+2NH3+2H2O↑;2NH3+H2SO4=(NH4)SO4.请计算:(1)完全反应后产生氨气
(2011?和平区二模)某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5g化肥样品与足量浓烧碱溶液加热,产生的氮气用100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如图所示,所涉及的反应为:(NH4)SO4+2NaOH=Na2SO4+2NH3+2H2O↑;2NH3+H2SO4=(NH4)SO4.请计算:(1)完全反应后产生氨气查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
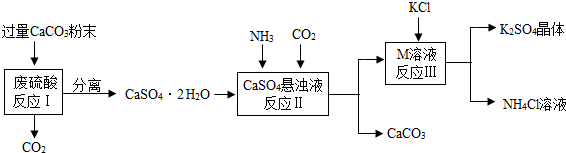
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 物质 | X | Y | Z | W |
| 反应前的质量(g) | 2 | 1 | 16 | 16 |
| 一段时间后的质量(g) | 17 | m | 6 | 11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com