
 某化学实验小组利用CuSO4、FeSO4的混合溶液进行如下探究实验.
某化学实验小组利用CuSO4、FeSO4的混合溶液进行如下探究实验.分析 根据铝的金属活动性比铁、铜强,铝会先置换出溶液中的铜,然后再置换出铁,铁的活动性排在氢之前,铜不会与酸反应生成氢气,向固体A中滴加稀盐酸,有气泡产生,说明固体中一定含有铁、铜,可能含有锌;无气泡产生,说明固体中一定不含铁和锌,所以溶液中一定含有硫酸铝和硫酸亚铁进行分析;
解答 解:(1)铝的金属活动性比铁、铜强,铝会先置换出溶液中的铜,然后再置换出铁,铁的活动性排在氢之前,铜不会与酸反应生成氢气,向固体A中滴加稀盐酸,有气泡产生,说明固体中一定含有铁、铜,可能含有锌;无气泡产生,说明固体中一定不含铁和锌,所以溶液中一定含有硫酸铝和硫酸亚铁,含有的离子铝离子和亚铁离子;
(2)由上述分析可知,发生的反应有:3CuSO4+2Al═3Cu+Al2(SO4)3,3FeSO4+2Al═3Fe+Al2(SO4)3,Fe+2HCl═FeCl2+H2↑.
故答案为:(1)铜和铁,铝离子和亚铁离子;(2)3CuSO4+2Al═3Cu+Al2(SO4)3(或3FeSO4+2Al═3Fe+Al2(SO4)3或Fe+2HCl═FeCl2+H2↑)等.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.


科目:初中化学 来源: 题型:推断题
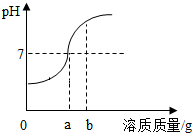 用稀硫酸和氢氧化钠溶液进行中和反应的实验时,反应过程中溶液的pH变化如图所示
用稀硫酸和氢氧化钠溶液进行中和反应的实验时,反应过程中溶液的pH变化如图所示查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | +5 | B. | +4 | C. | +3 | D. | +2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢氧化钠能和酸反应,生活中可用氢氧化钠治疗胃酸过多 | |
| B. | 气体分子间间隔大,6000L氧气加压可装入40L的钢瓶中 | |
| C. | 浓硫酸具有吸水性,可用作干燥剂 | |
| D. | 洗洁精有乳化功能,能洗去碗筷上的油污 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 丙氨酸由碳、氢、氧、氮四种元素组成 | |
| B. | 一个丙氨酸分子中含有13个原子 | |
| C. | 丙氨酸的相对分子质量为89 | |
| D. | 丙氨酸中氧元素与氮元素的质量比为2:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 方案 | 实验步骤 | 实验现象 |
| 方案一 | 取少量溶液于试管中,滴加紫色石蕊溶液 | 紫色石蕊溶液变红色 |
| 方案二 | 取少量氧化铜粉末于试管中,加入一定量的烧杯中的溶液 | 黑色粉末逐渐溶解,溶液变蓝色 |
| 方案三 | 取少量烧杯内溶液于另一支试管中,加入碳酸钠溶液等 | 产生气泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com