
【题目】图中A、B分别是某微粒的结构示意图,回答下列问题:
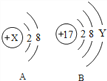
(1)若A表示某稀有气体元素的原子,则该元素的元素符号为 ______ ;
(2)若B表示某元素的原子,则y= ______ ,该元素的原子在化学反应中容易 ______ (填“失去”或“得到”)电子.
(3)若A是阳离子的结构示意图,则x可能是下列中的 ______ (填字母序号).
a.8b.10c.11d.12
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:初中化学 来源: 题型:
【题目】下列有关物质燃烧现象的叙述中,正确的是
A.铁丝在氧气中燃烧:火星四射,生成红色固体
B.蜡烛在氧气中燃烧:发出白光
C.镁条在空气中燃烧:生成氧化镁
D.红磷在空气中燃烧:发出白光,生成大量的白雾
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】正确量取7.5mL液体,应选用的一组仪器是
①5mL量筒 ②10mL量筒 ③20mL量筒 ④胶头滴管.
A.③④ B.①②④ C.②④ D.只有③
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】选用①物理变化 ②化学变化 ③物理性质 ④化学性质,填写下列空白(用序号)
(1)煤气燃烧 ;(2)水沸腾变成水蒸气 ;
(3)酒精易挥发 ;(4)铁在潮湿的空气中易生锈 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】室温下,分别向四个装有等质量的水的烧杯中加入硝酸钾固体,且所加固体的质量依次减少,充分溶解后如图所示,回答下列问题.

(1) ____中盛的一定是饱和溶液; ______ 中盛的可能是饱和溶液, ______ 中盛的一定是不饱和溶液(以上均填序号);
(2)若对A、B两烧杯进行加热,随着温度的升高,先变成不饱和溶液的是 ______ (填序号);
(3)欲使接近饱和的硝酸钾溶液变为饱和溶液,可采取的方法是 ______ .(写出一种方法即可)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】常温下,某气体能溶于水,密度比空气小,收集该气体可采用的方法是
A. 向上排空气法 B. 向下排空气法
C. 排水法或向下排空气法 D. 排水法或向上排空气法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组的同学们在老师的指导下进行实验室制取氧气的实验。
(1)甲同学称取一定质量的高锰酸钾固体放入大试管中,将温度控制在250℃加热制取O2。实验结束时,乙同学发现用排水法收集到的氧气大于理论产量。针对这一现象,进行了如下探究:
[提出猜想]猜想I:反应生成的二氧化锰分解放出氧气;猜想II:反应生成的锰酸钾分解放出氧气;猜想III:_______________________________
[实验验证]同学们分成两组,分别进行下列实验:第一组同学取一定质量的二氧化锰,在250℃条件下加热一段时间,冷却后测得二氧化锰的质量不变,则猜想______错误;第二组同学取锰酸钾在250℃条件下加热,没有用测定质量的方法得出了猜想II正确的结论。该组同学选择的实验方法是______________________。
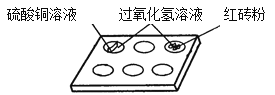
(2白色点滴板是带有空穴的白色瓷板,可用作微型化学反应。在寻找新催化剂时,将一定量的红砖粉、硫酸铜溶液……分别加入点滴板中,再分别滴入过氧化氢溶液(如图所示),观察到过氧化氢溶液产生气泡的速率加快。据此现象得出结论:红砖粉、硫酸铜溶液等也能做过氧化氢溶液的催化剂。小红认为不正确,
理由一:未探究它们的质量在反应前后是否不变;
理由二:_________________________________________________。
白色点滴板作为反应容器的优点有__________________________________________。
( 3)通过对催化剂的实验探究,同学们还想探究影响反应速率的其他因素。于是在老师的指导下通过查阅资料设计了实验室用锌与稀硫酸反应制取氢气的实验。反应过程中,用前 10 min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
验实号编 | 试剂 | 前 10 min 内产生的氢气体积(mL) | |
不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
a | 纯锌 | 30 mL 30 % | 564.3 |
b | 含杂质的锌 | 30 mL 30 % | 634.7 |
c | 纯锌 | 30 mL 20 % | 449.3 |
d | 纯锌 | 40 mL 30 % | 602.8 |
① 比较实验 a 和实验 b ,可以得到的结论是________________________。
② 为了研究硫酸浓度对反应快慢的影响,需比较实验_____和实验_____(填编号)。
③ 控制其他条件相同,需控制的条件是__________________(例举一种条件即可)。
通过实验,同学们明白了一个道理,物质的纯度对化学反应速率有很大影响,但是不一定是纯度越大反应速率越快,有时候也会有一些特殊情况。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)下表是NaCl和KNO3在不同温度时的溶解度,请根据相关信息回答下列问题。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
(1)60℃时,在100 g水里溶解_________g KNO3时,溶液才可达到饱和状态。
(2)下图为NaCl 和KNO3的溶解度曲线,则表示NaCl的溶解度曲线是_________(填“甲”或“乙”);其中温度t的范围可能在________(填字母序号)。

A.10℃~20℃之间 B.20℃~30℃之间
C.30℃~40℃之间 D.40℃~50℃之间
(3)请根据上表或图示总结出一条具有一定规律的结论 。
(4)在0℃时,分别在100 g 水中加入30 g NaCl 和KNO3固体,再加热到60℃时(假设溶剂不损耗),NaCl溶液为______(填“饱和”或“不饱和”)溶液。加热前后,有关两种溶液的说法正确的是_____(填字母序号)。
A.0℃时,两溶液中溶质的质量分数相同
B.60℃时,两溶液中溶质的质量分数相同
C.加热前后,NaCl溶液中溶质的质量分数由小变大
D.加热前后,KNO3溶液中溶质的质量分数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com