
分析 碳酸钾和稀盐酸反应生成氯化钾、水和二氧化碳,反应前后的质量差即为反应生成二氧化碳的质量,根据二氧化碳的质量可以计算碳酸钾的质量和生成的氯化钾的质量,进一步可以计算样品中氯化钾的质量分数和所得溶液中溶质的质量分数.
解答 解:(1)设碳酸钾的质量为x,生成氯化钾的质量为y,
反应生成二氧化碳的质量为:30g+100g-125.6g=4.4g,
K2CO3+2HCl═2KCl+H2O+CO2↑,
138 149 44
x y 4.4g
$\frac{138}{x}$=$\frac{149}{y}$=$\frac{44}{4.4g}$,
x=13.8g,y=14.9g,
样品中氯化钾的质量分数为:$\frac{30g-13.8g}{30g}$×100%=54%,
答:样品中氯化钾的质量分数为54%.
(2)所得溶液中溶质的质量分数为:$\frac{30g-13.8g+14.9g}{125.6g}$×100%=24.8%,
答:所得溶液中溶质的质量分数为24.8%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.


科目:初中化学 来源: 题型:解答题
 化学物质之间的反应关系也可以构建出一些图形.将铝丝(经砂纸打磨)、稀盐酸、氢氧化钠溶液、氯化铜溶液这四种物质填在合适的位置上,其中C所表示的物质不是单质.(“-”连接的物质能反应,“→”连接的物质能转化)
化学物质之间的反应关系也可以构建出一些图形.将铝丝(经砂纸打磨)、稀盐酸、氢氧化钠溶液、氯化铜溶液这四种物质填在合适的位置上,其中C所表示的物质不是单质.(“-”连接的物质能反应,“→”连接的物质能转化)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 甲、乙两种固体物质的溶解度曲线如图所示.下列有关叙述中错误的是( )
甲、乙两种固体物质的溶解度曲线如图所示.下列有关叙述中错误的是( )| A. | t2℃时甲的溶解度比乙的大 | |
| B. | t1℃时,甲和乙的溶解度相等 | |
| C. | 升高温度可将甲的饱和溶液变为不饱和溶液 | |
| D. | 将甲、乙的饱和溶液从t2℃降到t1℃,析出的甲的质量大 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验操作 | 实验现象 | 实验结论 |
| (a)取少量样品于试管中,加水溶解后,加入过量的氯化钙溶液; | 有白色沉淀产生 | 样品中含有碳酸钠 |
| (b)静置,取上层清液于试管中,滴加酚酞试液. | 溶液变红色 | 样品中含有氢氧化钠 |
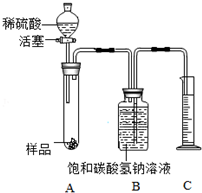
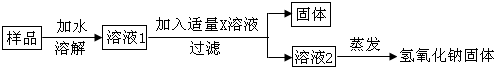
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
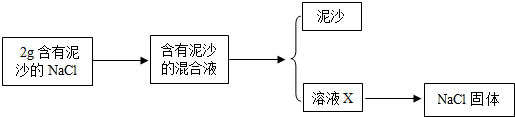
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com