
科目:初中化学 来源: 题型:阅读理解
| 等质量(ag)的金属与足量盐酸反应 | 镁 | 铁 | 锰 |
| 金属的相对原子质量 | 24 | 56 | 55 |
| 产生氢气的质量(g) | a/12 | a/28 | a/27.5 |
| 找到的规律 | 等质量相同价态的金属与足量的酸完全反应,相对原子质量越大(小),产生的氢气的质量越少(多) 等质量相同价态的金属与足量的酸完全反应,相对原子质量越大(小),产生的氢气的质量越少(多) | ||
查看答案和解析>>
科目:初中化学 来源: 题型:
某校化学实验室废液桶中收集了溶解大量FeSO4、CuSO4的废水,若直接排放到下水道不仅造成重金属污染而且造成浪费。初三(2)班的同学,准备运用刚学到的“常见金属活动性顺序表”结合其他有关化学知识对废水进行处理。
(1)复习常见金属活动顺序表,在下表空格中分别填入对应的元素符号。
K Ca Mg Al Fe Sn Pb (H) Cu Hg Pt Au
![]() 金属活动性由强到弱
金属活动性由强到弱
(2)设计除去铜离子,回收硫酸亚铁晶体和铜的实验方案,讨论有关问题:
 |
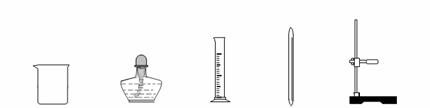 ①废水在加入金属X前需进行过滤,目的是将其中 性杂质除去。进行过滤的操作所需的仪器有: 、 、 、 (请从下图中选择合适仪器,并用仪器名称填写)。
①废水在加入金属X前需进行过滤,目的是将其中 性杂质除去。进行过滤的操作所需的仪器有: 、 、 、 (请从下图中选择合适仪器,并用仪器名称填写)。
②金属X是 ,其加入废水后发生反应的化学方程式为 ;
溶液Y是 ,利用其除去铜中杂质,有关反应的化学方程式为 。
③从滤液中获取硫酸亚铁晶体的操作方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com