
| ŹµŃéŠņŗÅ | ¼ÓČėĻ”ŃĪĖįµÄÖŹĮæ/g | Ź£ÓąĪļÖŹµÄÖŹĮæ/g |
| µŚ1“Ī | 10 | 5.5 |
| µŚ2“Ī | 10 | 3 |
| µŚ3“Ī | 10 | 1.6 |
| µŚ4“Ī | 10 | m |
·ÖĪö ±¾ĢāŹĒÓŠ¹Ų»Æѧ·½³ĢŹ½µÄ¼ĘĖćĢā£¬±¾ĢāŹōÓŚ±ķøńŠĶ¼ĘĖćĢā£®“ĖĄąĢāÄæŠĪŹ½¶ąŃł£¬Ö÷ŅŖÓŠĮ½“óĄą£ŗŅ»ŹĒøł¾ŻÖŹĮæŹŲŗć¶ØĀÉ£¬Óöµ½²īÖµĒóĘųĢ壻¶žŹĒ¼õÉŁµÄÖŹĮæÕżŗĆŹĒ²Ī¼Ó·“Ó¦µÄ¹ĢĢåÖŹĮ森±¾ĢāŹōÓŚµŚ¶žÖÖĄąŠĶ£¬Ö»ŅŖČĻÕę·ÖĪö±ķøńµÄŹż¾Ż£¬Ē°Čż“Ī¼ÓČėŃĪĖį£¬Ó¦øƶ¼ŹĒ¼õÉŁ2.5g£¬¶ųµŚČż“ĪŹĒ1.4g£¬ĖµĆ÷µŚČż“ĪŃĪĖįÓŠŹ£Óą£¬Ģ¼ĖįøĘŅŃ¾Č«²æ·“Ó¦£»Ē°Į½“ĪŃĪĖįČ«²æ·“Ó¦£¬æÉŅŌČĪŃ”Ņ»“Ī¼ĘĖćŃĪĖįµÄÖŹĮæ·ÖŹż£®¾·ÖĪöŌÓÖŹµÄÖŹĮæŹĒ1.6g£¬Ģ¼ĖįøĘÖŹĮæ¾ĶŹĒ6.4g£®Ö»ŅŖÉĻĻĀĮŖĻµ£¬ĪŹĢā¾Ķ»įÓČŠ¶ų½ā£®
½ā“š ½ā£ŗ£Ø1£©Ē°Čż“Ī¼ÓČėŃĪĖį£¬ŃłĘ·ĻūŗĵÄÖŹĮæ·Ö±šĪŖ2.5”¢2.5”¢1.4£¬¶ųĆæ“Ī¼ÓµÄŃĪĖįµÄĮæĻąĶ¬£¬ÓÉ“ĖæɼūµŚČż“Ī¼ÓČėŃĪĖįŗó£¬ŃłĘ·ÖŠĢ¼ĖįøĘŅŃĶźČ«·“Ó¦£¬ĖłŅŌm=1.6g£»
£Ø2£©ÓɱķÖŠŠÅĻ¢æÉÖŖ£¬Ź£ÓąµÄ1.6æĖĪŖŌÓÖŹµÄÖŹĮ棬ŌņĢ¼ĖįøʵÄÖŹĮæĪŖ8g-1.6g=6.4g£¬$\frac{6.4g}{8g}$”Į100%=80%£»
£Ø3£©ÓÉÓŚÖ»ÓŠĒ°Į½“ĪŃĪĖįĶźČ«·“Ó¦£¬ĖłŅŌĖćŃĪĖįµÄÖŹĮææÉŅŌÓƵŚŅ»“Ī»ņĒ°Į½“Ī°“ÕÕµŚŅ»“ĪĖć£ŗ£Ø×¢Ņā£ŗŹÆ»ŅŹÆÓėŃĪĖį·“Ó¦±ČĪŖ1£ŗ2£©£¬ĖłŅŌ
½ā£ŗÉčŃĪĖįÖŠČÜÖŹµÄÖŹĮæĪŖx
CaCO3+2HCl=CaCl2+CO2ӟ+H2O
100 73
8g-5.5g x
$\frac{100}{8g-5.5g}$=$\frac{73}{x}$
x=1.825g
ĖłŅŌĻ”ŃĪĖįµÄČÜÖŹÖŹĮæ·ÖŹżĪŖ£ŗ$\frac{1.825g}{10g}$”Į100%=18.25%£»
²Ī¼Ó·“Ó¦µÄĢ¼ĖįøĘĪŖ£ŗ8g-1.6g=6.4g£¬
ÉčŠčŅŖŃĪĖįµÄÖŹĮæĪŖz£¬Éś³É¶žŃõ»ÆĢ¼ÖŹĮæĪŖy£¬Éś³ÉĀČ»ÆøĘÖŹĮæĪŖm£¬
CaCO3+2HCl=CaCl2+CO2ӟ+H2O
100 73 111 44
6.4g z”Į18.25% m y
$\frac{100}{6.4g}$=$\frac{73}{z”Į18.25%}$=$\frac{44}{y}$=$\frac{111}{m}$
y=2.816g
z=25.6g
m=7.104g
ĖłŅŌ·“Ó¦ŗóĖłµĆČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹżĪŖ£ŗ$\frac{7.104g}{6.4g+25.6g-2.816g}$”Į100%=24.3%£®
¹Ź“š°øĪŖ£ŗ£Ø1£©1.6£»
£Ø2£©80%£»
£Ø3£©18.25%£»
£Ø4£©24.3%£®
µćĘĄ ±¾æ¼µćŹĒÓŠ¹Ų»Æѧ·½³ĢŹ½µÄ¼ĘĖćĢā£¬ŹōÓŚ±ķøńŠĶ¼ĘĖćĢā£®½ü¼øÄźµÄÖŠæ¼¼ĘĖćĢā£¬ĢāŠĶ¶ąŃł£¬Ö÷ŅŖÓŠ±ķøńĢā”¢Ķ¼ĻóĢā”¢±źĒ©Ģā”¢Ķ¼ĻóŗĶ±ķøńĻąĮŖĻµµÄ×ŪŗĻĢāŅŌ¼°ÓėĪÄ×ÖŠšŹöĢāµČ£¬“Ó²»Ķ¬µÄ·½Ćęæ¼²éĮĖѧɜµÄŹ¶Ķ¼ÄÜĮ¦”¢·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦£®Ķ¬Ń§ĆĒŅŖČĻÕę°ŃĪÕ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | A | B | C | D |
| »ÆѧŹ½ | C2H6 | C3H8 | C4H10 | C5H12 |
| ·Šµć/”ę | -88.6 | -42.1 | -0.5 | 36.1 |
| ČŪµć/”ę | 183.8 | 189.7 | 138.4 | 129.7 |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
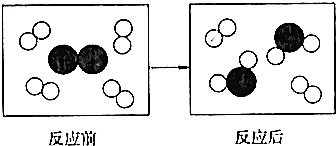
| A£® | 4X+YØTX4Y | B£® | X2+Y2=2XY | C£® | 2X2+Y2ØT2X2Y | D£® | 4X2+Y2ØT2X4Y |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CO32-ŗĶNO3-Ą“×ŌĶ¬Ņ»¹¤³§ | B£® | OH-ŗĶNO3-Ņ»¶Ø²»ŌŚĶ¬Ņ»¹¤³§ | ||
| C£® | H+ŗĶBa2+Ņ»¶Ø²»ŌŚĶ¬Ņ»¹¤³§ | D£® | Na+ŗĶNO3-Ą“×ŌĶ¬Ņ»¹¤³§ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
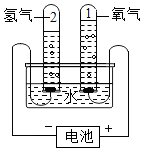 µē½āĖ®ŹµŃé
µē½āĖ®ŹµŃé²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com