
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:初中化学 来源: 题型:阅读理解

| ||
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 固体混合物溶液质量 | 100g | 100g | 100g | 100g |
| 加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的质量 | 4g | m | 10g | 10g |
| 工业纯碱标准:(Na2CO3% ) | |||
| 优等品 | 一等品 | 合格品 | 次品 |
| ≥95 | ≥80 | ≥75 | ≤40 |
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省九年级下学期期中考试化学试卷(解析版) 题型:探究题
(14分)某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【产品原理】
该厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3晶体和NH4Cl溶液,反应的化学方程式为: ;后分离出NaHCO3,加热制得纯碱。
【生产流程】

|
⑴ NH4Cl NH3↑+HCl↑
⑵ 已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
|
物质 |
NaCl |
NaHCO3 |
NH4Cl |
NH3 |
CO2 |
|
溶解度 |
36.0g |
9.6g |
37.2g |
710 |
0.9 |
【问题讨论】
⑴操作Ⅰ、Ⅱ中,相同操作的名称为 。反应①中发生了两个反应,写出其中一个化学方程式: ,反应①加适量的盐酸,适量是指 。
⑵检验挥发性气体C的方法 。
⑶上述生产流程中可循环使用的是 (填序号)。
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
【组成确定】
⑴ 称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
⑵ 另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
|
|
实验一 |
实验二 |
实验三 |
实验四 |
|
固体混合物溶液质量 |
100g |
100g |
100g |
100g |
|
加入CaCl2溶液质量 |
10g |
20g |
30g |
40g |
|
生成的沉淀的质量 |
4g |
m |
10g |
10g |
称取该纯碱样品44 g固体混合物,加水配成400g溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见表:
请分析表中数据回答并计算:
⑴m= g;
⑵在实验三中,完全反应后所得溶液中溶质氯化钠的质量分数是多少?(要求写计算过程,结果保留0.1%)
【总结反思】
请通过计算并结合下表判断此纯碱样品等级为 品,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小。

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【产品原理】
该厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3晶体和NH4Cl溶液,反应的化学方程式为: ;后分离出NaHCO3,加热制得纯碱。
【生产流程】
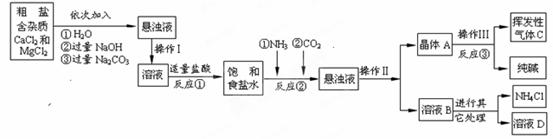
|
⑴ NH4Cl NH3↑+HCl↑
⑵ 已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
【问题讨论】
⑴操作Ⅰ、Ⅱ中,相同操作的名称为 。反应①中发生了两个反应,写出其中一个化学方程式: ,反应①加适量的盐酸,适量是指 。
⑵检验挥发性气体C的方法 。
⑶上述生产流程中可循环使用的是 (填序号)。
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
【组成确定】
⑴ 称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
⑵ 另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 固体混合物溶液质量 | 100g | 100g | 100g | 100g |
| 加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的质量 | 4g | m | 10g | 10g |
称取该纯碱样品44 g固体混合物,加水配成400g溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见表:
请分析表中数据回答并计算:
⑴m= g;
⑵在实验三中,完全反应后所得溶液中溶质氯化钠的质量分数是多少?(要求写计算过程,结果保留0.1%)
【总结反思】
请通过计算并结合下表判断此纯碱样品等级为 品,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小。
|

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com