【答案】
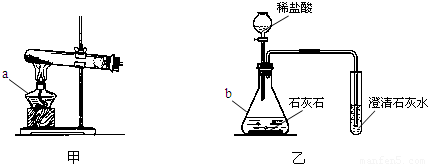
分析:(1)熟悉常见仪器的名称和用途;
(2)根据高锰酸钾分解的反应原理书写方程式,依据氧气的密度和溶解性确定收集方法,二氧化锰不溶于水,是过氧化氢分解反应的催化剂;
(3)根据二氧化碳与澄清石灰水反应,使澄清石灰水变浑浊的性质判断试管内的现象,并据此写出方程式;
实验与结论:
可根据二氧化碳的性质、碳酸氢钙能溶于水,溶液的酸碱度的测定方法及碳酸根、碳酸氢根离子的检验分析解答本题;
交流与反思:根据探究过程,我们可以得到许多经验:如要重视观察现象,要多提出疑问,或根据探究过程直接得出化学结论.
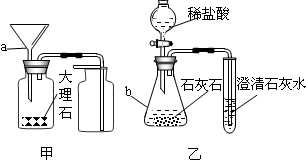
解答:解:(1)图中仪器分别是酒精灯和锥形瓶;
(2)高锰酸钾加热生成锰酸钾、二氧化锰和氧气,方程式是2KMnO
4
K
2MnO
4+MnO
2+O
2↑,氧气的密度比空气大,可用向上排空气法收集,不易溶于水,可用排水法收集,二氧化锰不溶于水,是过氧化氢分解反应的催化剂,方程式是2H
2O
2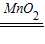
2H
2O+O
2↑;
(3)石灰水的主要成分是氢氧化钙,通入二氧化碳后,生成碳酸钙和水,碳酸钙是难溶于水的白色固体,所以可看到试管里有白色沉淀,其反应的化学方程式为:CO
2+Ca(OH)
2═CaCO
3↓+H
2O;
(2)实验与结论:
实验Ⅰ:要验证猜想①溶液呈酸性,可用石蕊试剂或PH试纸测定,由实验现象知pH=8,可以推知实验操作是用PH试纸,其操作过程是用玻璃棒蘸取待测液涂在pH试纸上,待充分变色后,和标准比色卡比较,即可得出溶液的PH值,pH=8,说明溶液呈碱性,故假设①不成立;
实验Ⅱ:要验证猜想②,生成了碳酸氢钙,其中含有碳酸氢根,就可用稀盐酸或稀硫酸来检验,如果加入酸,将会有二氧化碳气体放出;
反思与交流:根据探究过程,我们可以得到许多经验:如要重视观察现象,要多提出疑问,或根据探究过程直接得出化学结论,即不溶物在一定条件下可以转化为可溶物.
故答案为:
(1)酒精灯;锥形瓶;
(2)2KMnO
4
K
2MnO
4+MnO
2+O
2↑;排水(或向上排空气);2H
2O
2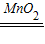
2H
2O+O
2↑;催化作用;
(3)白;CO
2+Ca(OH)
2═CaCO
3↓+H
2O;
【实验与结论】
| 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ:把一小片pH试纸放在一块干净的玻璃片上,用 玻璃棒蘸取沉淀溶解成澄清的溶液沾在试纸上,把试纸呈现的颜色与标准比色卡对照. | 测得被测液的pH=8 | 猜想①不成立.(填“成立”或“不成立”) |
| 实验Ⅱ:取沉淀溶解成澄清的溶液于另一支试管中,加入 稀盐酸(或硫酸). | 有气体产生 | 猜想②成立 |
反思与交流:不溶物在一定条件下可转化为可溶物.(合理即可)
点评:本题考查知识全面,既考查了实验室制取气体的相关知识,又通过探究题考查了学生的思维和实验能力,探究题往往起点高,落点低,考查的内容还是学过的内容,解题时既要针对题目的要求,又要联系所学习的知识,经过合理分析、推导后再回答.

 K2MnO4+MnO2+O2↑,氧气的密度比空气大,可用向上排空气法收集,不易溶于水,可用排水法收集,二氧化锰不溶于水,是过氧化氢分解反应的催化剂,方程式是2H2O2
K2MnO4+MnO2+O2↑,氧气的密度比空气大,可用向上排空气法收集,不易溶于水,可用排水法收集,二氧化锰不溶于水,是过氧化氢分解反应的催化剂,方程式是2H2O2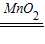 2H2O+O2↑;
2H2O+O2↑;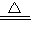 K2MnO4+MnO2+O2↑;排水(或向上排空气);2H2O2
K2MnO4+MnO2+O2↑;排水(或向上排空气);2H2O2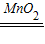 2H2O+O2↑;催化作用;
2H2O+O2↑;催化作用;

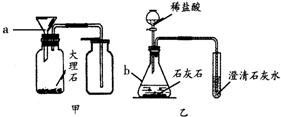

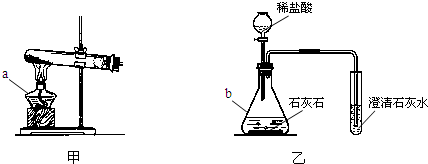
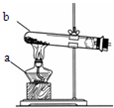 请你结合装置图回答问题:
请你结合装置图回答问题: