
| A. | 单宁酸由碳、氢、氧三种元素组成 | |
| B. | 一个单宁酸分子是由76个碳原子、52个氢原子和46个氧原子构成 | |
| C. | 单宁酸中碳、氧元素的质量比为38:23 | |
| D. | 单宁酸中氢元素的质量分数最小 |
分析 A、根据单宁酸化学式的含义进行分析判断.
B、根据1个单宁酸分子的构成进行分析判断.
C、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
D、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
解答 解:A、单宁酸是由碳、氢、氧三种元素组成的,故选项说法正确.
B、一个单宁酸分子是由76个碳原子、52个氢原子和46个氧原子构成,故选项说法正确.
C、单宁酸分子中碳、氧元素的质量比为(12×76):(16×46)≠38:23,故选项说法错误.
D、单宁酸分子中C、H、O三种元素的质量比为(12×76):(1×52):(16×46)=228:13:184,则单宁酸中氢元素的质量分数最小,故选项说法正确.
故选:C.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.


科目:初中化学 来源: 题型:选择题
| A. | 人类向空气中排放的一些有害物质使臭氧层受到不同程度的破坏,我国正倡导生产和使用无氟冰箱 | |
| B. | 无铅汽油的使用可以提高城乡空气质量 | |
| C. | 保护森林植被,大规模进行人工造林和绿化,是防止空气污染的重要措施 | |
| D. | 稀有气体很难和其他物质发生反应,所以没有多大用途 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 干冰用于人工降雨 | B. | 稀有气体用作多用途的电光源 | ||
| C. | 焊接金属时用氮气作保护气 | D. | 铜用于制作导线 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁 | B. | 铜 | C. | 碘 | D. | 锌 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
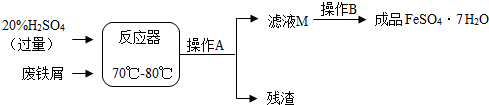
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com