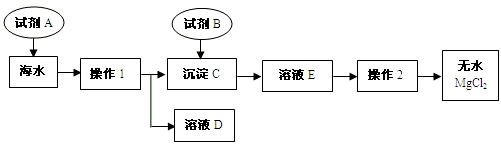
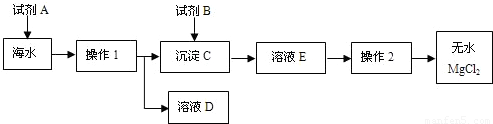
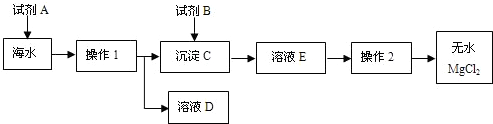
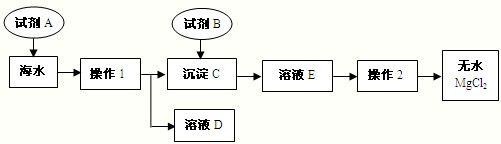
解:(1)经过操作I后出现了沉淀和溶液,而所有的钠的化合物都溶于水,只能是镁离子的沉淀,贝壳的主要成分是碳酸钙,碳酸钙在高温的条件下产生的氧化钙和水会生成氢氧化钙,
碳酸钙在高温的条件下生成氧化钙和二氧化碳,氧化钙和水生成氢氧化钙,氢氧化钙和氯化镁生成氢氧化镁沉淀和氯化钙,
故答案为:CaCO
3
CaO+CO
2↑;CaO+H
2O=Ca(OH)
2;MgCl
2+Ca(OH)
2=Mg(OH)
2↓+CaCl
2(2)除了题中给出的仪器之外,还需要有倾倒液体的装置和盛放滤液的装置,故答案为:烧杯
(3)经过操作I后将氢氧化镁分离了出来,而后面需要得到无水氯化镁,所以加入的试剂B就是为了生成氯化镁,需要加入盐酸,故答案为:Mg(OH)
2+2HCl=MgCl
2+2H
2O
(4)经过操作I后的溶液中除了氯化钠之外,还有反应剩余的氢氧化钙和反应生成的氯化钙,要除去钙离子就需要碳酸根离子,然后再用盐酸来调节溶液的pH值,故答案为:Na
2CO
3、盐酸
(5)镁的相对原子质量是24,氯的相对原子质量是35.5,所以MgCl
2的相对分子质量=24+35.5×2=95,故答案为:95,
镁在氯化镁中的质量分数为:
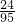
×100%,所以12克的镁需要在47.5克的氯化镁中,故答案为:47.5
分析:(1)经过操作I后出现了沉淀和溶液,而所有的钠的化合物都溶于水,只能是镁离子的沉淀,根据贝壳的主要成分是碳酸钙,碳酸钙在高温的条件下产生的氧化钙和水会生成氢氧化钙,结合这些知识书写方程式.
(2)根据过滤除了所给的仪器外,还需要倾倒液体的装置和盛放滤液的装置进行分析,
(3)根据试剂B是用来溶解沉淀C的,以及最后得到的氯化镁进行分析,
(4)根据(1)的反应可知,反应后的溶液中除了反应剩余的氢氧化钙外,还有反应生成的氯化钙,需要将两者除去来分析,
(5)根据元素的相对原子质量进行计算,根据氯化镁中镁元素的质量分数进行计算.
点评:在解此类题时,首先要弄清楚生成流程中各个操作步骤的作用和所加试剂的作用,然后结合题中的问法逐一的解答.
过滤操作可以将固体和液体进行分离.

 CaO+CO2↑;CaO+H2O=Ca(OH)2;MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
CaO+CO2↑;CaO+H2O=Ca(OH)2;MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2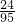 ×100%,所以12克的镁需要在47.5克的氯化镁中,故答案为:47.5
×100%,所以12克的镁需要在47.5克的氯化镁中,故答案为:47.5

 考前必练系列答案
考前必练系列答案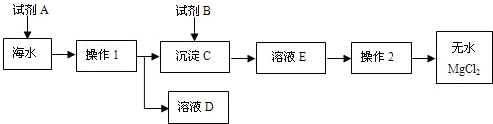
 CaO+CO2↑)
CaO+CO2↑)