
分析 【分析推理】
(1)根据所设计的实验:向红色固体中加入足量稀硫酸,由于铜不能与稀硫酸发生反应而Cu2O能与稀硫酸反应生成铜和硫酸铜,反应后溶液呈蓝色说明固体中含有Cu2O;若无现象,则固体中只含有铜;
(2)根据碳与CuO发生反应,生成亮红色固体和二氧化碳,写出反应的化学方程式;
【交流讨论】
(1)根据燃烧的条件解答;
(2)根据CuSO4开始分解生成CuO和另一种氧化物;此反应前后各元素的化合价保持不变,利用质量守恒定律解答.
解答 解:【分析推理】
(1)由于铜不能与稀硫酸发生反应而Cu2O能与稀硫酸反应生成铜和硫酸铜,反应后溶液呈蓝色说明固体中含有Cu2O;若无现象,则固体中只含有铜;根据探究,取少量红色固体于试管中,加入稀硫酸,固体不溶解,溶液仍为无色,则固体中只含有铜;同时也说明滤纸燃烧时的温度低于1000℃;
(2)碳与CuO发生反应,生成亮红色固体和二氧化碳,反应的化学方程式为:C+2CuO $\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;
【交流讨论】
(1)将浸有硫酸铜溶液的滤纸点燃,刚开始不能燃烧,是因为没有达到燃烧所需的最低温度(着火点);
(2)CuSO4开始分解生成CuO和另一种氧化物;此反应前后各元素的化合价保持不变,故CuSO4受热分解生成CuO和SO3.
故答案为:
【分析推理】
(1)铜;B;
(2)C+2CuO $\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;
【交流讨论】
(1)没有达到燃烧所需的最低温度(着火点);
(2)SO3.
点评 在研究物质组成时,通过定性的探究实验不能确定某组成成分时,可通过定量研究加以判断;定量研究时,质量守恒思想是进行推断的根本依据.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:初中化学 来源: 题型:选择题

| A. | 甲的化学式为CH2 | |
| B. | 反应中甲、乙、丙的分子个数比为1:1:1 | |
| C. | 该反应属于化合反应 | |
| D. | 丙中C、H、O元素的质量比为12:3:8 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
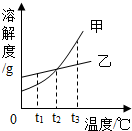 根据如图的溶解度曲线,判断下列说法中不正确的是( )
根据如图的溶解度曲线,判断下列说法中不正确的是( )| A. | t1℃时,甲物质的溶解度小于乙物质的溶解度 | |
| B. | t2℃时,甲、乙两物质的饱和溶液中含甲、乙两物质的质量相等 | |
| C. | 将t3℃的甲、乙两物质的饱和溶液降温至t2℃时,都会析出晶体 | |
| D. | 当甲物质中混有少量乙物质时,可采用冷却热饱和溶液的方法提纯甲 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
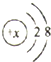
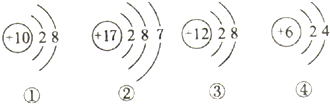
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 为了研究炼铁的主要反应实质,某化学兴趣小组的同学用一氧化碳还原三氧化二铁做实验.装置如图.请回答下列问题:
为了研究炼铁的主要反应实质,某化学兴趣小组的同学用一氧化碳还原三氧化二铁做实验.装置如图.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 氧气是一种化学性质比较活泼的气体,能支持燃烧.
氧气是一种化学性质比较活泼的气体,能支持燃烧.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com