
| n | m |
| n |
| m |
| 126 |
| mg |
| 217 |
| ng |
| n |
| m |
| 217 |
| 126 |
| 142 |
| 233 |
| mg |
| ng |
| n |
| m |
| 233 |
| 142 |
| n |
| m |
| 233 |
| 142 |
| n |
| m |
| 217 |
| 126 |
| 2×126 |
| 2×142 |
| xg |
| y |
| 142x |
| 126 |
| 142x |
| 126 |
| n |
| m |
| 217 |
| 126 |
| 4.7g×217 |
| 126 |
| n |
| m |
| 233 |
| 142 |
| 5.3g×233 |
| 142 |
| 233 |
| 142 |
| n |
| m |
| 217 |
| 126 |


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
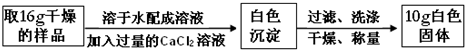
查看答案和解析>>
科目:初中化学 来源: 题型:
 我校化学科研究性学习小组进行了一个有趣的实验探究:
我校化学科研究性学习小组进行了一个有趣的实验探究:查看答案和解析>>
科目:初中化学 来源: 题型:
| 反应前 | 反应后 | ||
| 实验 数据 |
干燥的样品质量 | 加入的CaCl2溶液质量 | 过滤、洗涤、干燥得滤渣的质量 |
| 8.0克 | 40.0克 | 5.0克 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com