
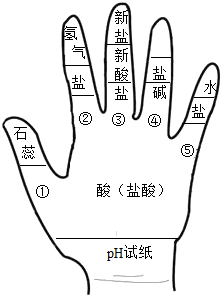
 构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:分析 (1)测定盐酸的pH时,用蒸馏水湿润pH试纸后,相当于盐酸溶液被稀释,酸性减弱.
(2)酸跟石蕊指示剂反应,使其颜色变为红色.
(3)跟某些盐反应生成另外的酸和盐,前提是有一种生成物为气体或沉淀.
(4)酸与碱的反应,符合两种化合物相互交换成分生成另两种化合物的反应,是复分解反应.
(5)图中⑤的性质内容较广,可以是指盐酸与碱反应,也可以是指盐酸与金属氧化物反应.
解答 解:(1)测定盐酸的pH时,用蒸馏水湿润pH试纸后,相当于盐酸溶液被稀释,酸性减弱,则结果会偏大.
(2)酸跟石蕊指示剂反应,使其颜色变为红色.
(3)跟某些盐反应生成另外的酸和盐,前提是有一种生成物为气体或沉淀,如盐酸和硝酸银溶液反应生成氯化银和硝酸,反应的化学方程式为:HCl+AgNO3=AgCl↓+HNO3.
(4)酸与碱的反应,符合两种化合物相互交换成分生成另两种化合物的反应,是复分解反应.
(5)铁锈属于金属氧化物,与盐酸反应生成盐和水,由此性质盐酸在工业上可用于除锈.
故答案为:
(1)偏大;
(2)石蕊变红;
(3)HCl+AgNO3=AgCl↓+HNO3(合理即可);
(4)复分解;
(5)盐酸除铁锈(合理即可).
点评 盐酸是酸的代表物质,要熟记酸的通性,要求同学们能写出每一项性质的化学方程式.


科目:初中化学 来源: 题型:解答题
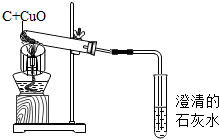 某同学设计了如下实验装置,进行碳还原性性质验证,对实验进行分析并回答:
某同学设计了如下实验装置,进行碳还原性性质验证,对实验进行分析并回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质和氧气发生的反应是氧化反应,所以发生氧化反应一定有氧气参加 | |
| B. | 分子、原子可以构成物质,所以物质一定是由分子、原子构成的 | |
| C. | 可燃物燃烧时温度需要达到着火点,所以可燃物的温度达到着火点一定能燃烧 | |
| D. | 化合物是含有不同元素的纯净物,所以含有不同种元素的纯净物一定是化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 单质--铝 金刚石 氮气 | B. | 碱--烧碱 纯碱 熟石灰 | ||
| C. | 氧化物--氧化铜 二氧化锰 生石灰 | D. | 混合物--空气 粗盐 牛奶 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气中二氧化碳含量的增加是形成酸雨的主要原因 | |
| B. | 利用乳化原理使用洗洁精洗涤餐具上的油污 | |
| C. | 人体缺钙会引起贫血 | |
| D. | 聚乙烯塑料属于天然有机高分子材料 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤及操作 | 实验现象 | 结论 |
| ①取部分该样品于试管中,加少量水 | 无明显放热现象 | 碱石灰样品中不含CaO和 氢氧化钠 |
| ②继续加足量水,振荡、静置 | 产生白色沉淀 | 样品中一定含有CaCO3 |
| ③从步骤②的试管中取少量上层清液于另一试管中,向其中滴加过量BaCl2溶液 | 产生白色沉淀 | / |
| ④将步骤③所得物质过滤,向滤液中滴加无色酚酞溶液 | 溶液变红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com