锌粉、铁粉、铝粉、镁粉的混合物Mg与一定量的稀硫酸恰好完全反应,蒸发水分后得固体R(不含结晶水)Ng,求反应中共生成氢气多少克?
解:H
2SO
4中硫酸根(SO
4)的质量为Ng-Mg=(N-M)g
H
2SO
4中H与SO
4的质量比为1×2:96=1:48,即H元素的质量是SO
4的质量的
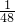
∴H
2SO
4中H的质量=
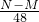
g,即反应后生成H
2的质量
答:生成氢气
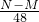
g.
故答案:(N-M)/48 g
分析:根据金属与硫酸反应生成硫酸盐和氢气,Mg为四种金属单质的质量,Ng为四种金属与稀硫酸完全反应生成的硫酸盐的质量,根据化学变化前后“元素质量不变”,由Ng-Mg为金属的硫酸盐中硫酸根的质量,也就是稀硫酸中硫酸根的质量.由硫酸根的质量可以计算硫酸的质量,再由硫酸的质量可计算出硫酸中H元素的质量,即生成的H
2的质量.
点评:本题初看无从下手,但利用化学变化前后元素(或原子团)种类、质量不变,就可以发现解决的窍门.

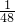
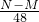 g,即反应后生成H2的质量
g,即反应后生成H2的质量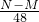 g.
g.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案