
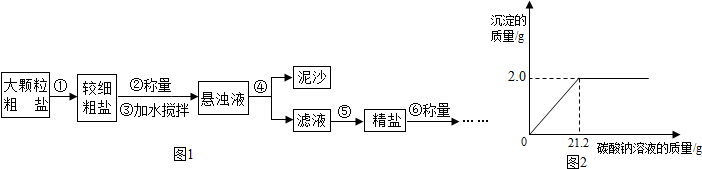
分析 (1)根据不溶于液体的固体和液体分离的方法考虑,根据精盐从溶液中析出的方法考虑;
(2)①欲求该粗盐样品中氯化钙的质量分数,须先根据化学方程式求出样品中氯化钙的质量,再利用质量分数公式计算即可.②欲求所的滤液的溶质质量分数,须先根据化学方程式求出溶质的质量,再根据溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%计算即可;此题需根据质量守恒定律求得滤液质量.
解答 解:(1)不溶于液体的固体和液体分离的方法是过滤,所以操作④是过滤;由于氯化钠的溶解度受温度影响不大,所以从溶液中结晶析出的方法是蒸发,用到的仪器有:铁架台、酒精灯、玻璃棒、蒸发皿;
(2)设粗盐样品中氯化钙的质量为x,生成的NaCl质量为y,则
Na2CO3+CaCl2=CaCO3↓+2NaCl
111 100 117
x 2.0g y
$\frac{111}{x}=\frac{100}{2.0g}=\frac{117}{y}$ 解得 x=2.22g,y=2.34g.
①该粗盐样品的纯度是$\frac{10g-2.22g}{10g}$×100%═77.8%,
②所得滤液中溶质的质量分数是:$\frac{10g-2.22g+2.34g}{10g+100g+21.2g-2.0g}$×100%═7.8%
故答为:(1)过滤,abdf;(2)①该粗盐样品的纯度77.8%;②所得滤液中溶质的质量分数7.8%.
点评 本题主要考查学生对物质质量分数和溶质质量分数的计算能力.学生需正确书写出化学方程式,然后根据化学方程式找出比例关系,列出比例式,并正确分析各物质之间的关系,才能正确答题.


科目:初中化学 来源: 题型:选择题
| A. | 稀盐酸遇石蕊溶液变红 | |
| B. | 细铁丝在氧气中点燃时,剧烈燃烧,火星四射,生成黑色固体 | |
| C. | 电解水时,与电源正、负两级相接的玻璃管内产生的气体体积比约是2:1 | |
| D. | 一氧化碳燃烧,火焰呈蓝色,产物是能使澄清石灰水变浑浊的二氧化碳气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 甲醛和苯都属于有机物 | |
| B. | 甲醛分子中含有水分子 | |
| C. | 甲醛中碳元素质量分数为40% | |
| D. | 苯中碳元素与氢元素的质量比为12:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe3+SO42- H+Cl- | B. | Mg2+Cl- OH- Na+ | ||
| C. | H+SO42- K+CO32- | D. | Na+Ba2+NO3 SO42- |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
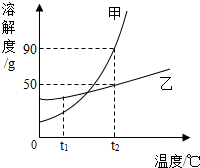 作图法是常用的数据处理方法,甲、乙两种物质的溶解度曲线如图所示,根据图示回答下列问题:
作图法是常用的数据处理方法,甲、乙两种物质的溶解度曲线如图所示,根据图示回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com