【答案】
分析:本题是一道综合性探究题,利用物质的性质不同设计实验加以甄别,来探究红色粉末的组成,先分别探究其中是否含有
Fe
2O
3、Cu等,逐步缩小范围,然后再选择适当的试剂和方法通过实验探究确定其组成.
【提出猜想】单独的氧化铁也是红色固体.
(1)根据【资料获悉】和探究(1)可排除猜想中的①,故红色粉末可能是Fe
2O
3 或Cu、Fe
2O
3的混合物.
(2)探究(3)利用了一氧化碳的还原性和定量实验来确定是否有铜.
【交流讨论】
(1)探究要考虑到CO具有可燃性,与玻璃管中的空气混合受热会发生爆炸,因此,应先通CO排尽玻璃管中的空气,然后再加热.
(2)利用I组数据计算出固体的氧化铁质量,与与混合物质量对比即可确定成分;
(3)氧化铁被还原出的铁粉呈黑色.
(4)一氧化碳一直向里通入,不会产生倒吸现象.
【反思评价】由于一氧化碳有毒,排放到空气中会污染空气,因此要进行尾气处理.
解答:解:【提出猜想】由于氧化铜氧化铁均是红色固体,所以红色粉末可能的组成有:①只有Cu;②只有 Fe
2O
3;
③是Cu、Fe
2O
3的混合物
故答案为:Fe
2O
3(2)根据资料:Cu在FeCl
3溶液中发生反应:2FeCl
3+Cu=2FeCl
2+CuCl
2 ;取红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解,溶液变色,可推断排除猜想中的①,故红色粉末可能是Fe
2O
3 或Cu、Fe
2O
3的混合物;
所以说乙同学的观点正确;
故答案为:乙
【交流讨论】
(1)根据CO具有可燃性,与玻璃管中的空气混合受热会发生爆炸,因此,应先通CO排尽玻璃管中的空气,然后再加热.所以在装置A中先通CO气体的作用是:排净装置中的空气(或防止CO和装置中的空气混合受热发生爆炸);
故答案为:排净装置中的空气(或防止CO和装置中的空气混合受热发生爆炸);
(2)第Ⅱ组数据,不能证明二氧化碳完全反应(石灰水少量);应该选择Ⅰ组的实验数据计算来确定红色粉末的组成.
设粉末中氧化铁的质量为x
3CO+Fe
2O
3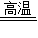
2Fe+3CO
2 固体△m
160 112 48
x 1.2g
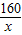
=
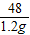
,x=4g
粉末共有5g,氧化铁4g,所以含有铜粉;
故答案为:Ⅰ;③;
(3)A装置中发生反应的化学方程式为:3CO+Fe
2O
3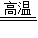
2Fe+3CO
2;红色粉末是Cu、Fe
2O
3的混合物,因此实验中观察到A装置中的现象为:部分红色粉末变黑;
故答案为:3CO+Fe
2O
3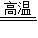
2Fe+3CO
2;部分红色粉末变黑;
(4)因为在反应中一直通入CO气体直至冷却,B中溶液不会倒吸到A装置中.
故答案为:不需要;因为一直通入CO气体,B中溶液不会倒吸到A装置中;
【反思评价】
此反应应考虑到CO有毒,排放到空气中会污染大气,显然,该装置没有对尾气进行处理;所以图装置有严重不足之处.改进方法为:在B装置后放一燃着的酒精灯将剩余气体烧掉(或用塑料袋等收集);
故答案为:在B装置后放一燃着的酒精灯将剩余气体烧掉(或用塑料袋等收集);
点评:此类题目主要对炼铁的实验原理、实验现象、操作步骤、尾气处理、装置连接及实验分析与评价等方面进行考查.熟练掌握该实验的反应原理以及实验注意事项是解决此类问题的关键.

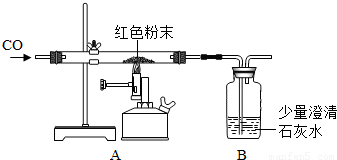 (2)丙同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:
(2)丙同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表: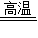 2Fe+3CO2 固体△m
2Fe+3CO2 固体△m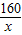 =
=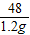 ,x=4g
,x=4g 2Fe+3CO2;红色粉末是Cu、Fe2O3的混合物,因此实验中观察到A装置中的现象为:部分红色粉末变黑;
2Fe+3CO2;红色粉末是Cu、Fe2O3的混合物,因此实验中观察到A装置中的现象为:部分红色粉末变黑; 2Fe+3CO2;部分红色粉末变黑;
2Fe+3CO2;部分红色粉末变黑;


